第二单元 微粒之间的相互作用 知识点题库
以下说法正确的是
A . 共价化合物内部可能有极性键和非极性键
B . 原子或离子间相互的吸引力叫化学键
C . 非金属元素的原子间只能形成共价键
D . 金属元素与非金属元素的原子间只形成离子键
下列物质既含有离子键又含共价键的是( )
A . NH3
B . Na2O
C . NH4Cl
D . H2O2
下列表示物质结构的化学用语或模型正确的是( )
A . 8个中子的碳原子的核素符号:12C
B . HF的电子式: 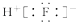 C . Cl﹣离子的结构示意图:
C . Cl﹣离子的结构示意图: 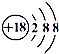 D . CH4分子的比例模型:
D . CH4分子的比例模型: 
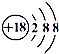 D . CH4分子的比例模型:
D . CH4分子的比例模型:
下列关于结构式的叙述中正确的是( )
A . 表示组成分子中的各原子在空间的位置
B . 以共价键相连的两原子间总以一条短线相连
C . 结构式和球棍模型在表示分子结构上作用相同
D . 用一条短线表示一对共用电子对的图式反映共价分子中各原子的连接顺序
氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有氢气放出,下列叙述不正确的是( )
A . NH4H是离子化合物,含有离子键和共价键
B . NH4H与水反应时,NH4H是还原剂
C . NH4H投入少量的水中,有两种气体产生
D . NH4H溶于水,所形成的溶液成酸性
下列物质含有共价键的是( )
A . Ar
B . MgCl2
C . Na2S
D . Na2O2
三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(图2),若原料完全反应生成三氯异氰尿酸,下列说法正确的是( )

A . 氰尿酸的分子式为C6N3O3H3
B . HClO的电子式为  C . 该转化过程有机物发生还原反应
D . 氰尿酸和次氯酸反应的物质的量之比为2 : 3
C . 该转化过程有机物发生还原反应
D . 氰尿酸和次氯酸反应的物质的量之比为2 : 3
分氟及氟产品在工农业生产中应用非常广泛,回答下列问题:

-
(1) 基态氟原子核外电子的运动状态有种,这些电子的电子云形状有种;氟原子的外围电子排布式为;
-
(2) NaHF2(氟化氢钠)电解可制氟气,NaHF2中所含作用力的类型有;与HF2-互为等电子体的分子有;(举一例).
-
(3) N2F2(二氟氮烯)分子中,氮原子的杂化轨道类型为,画出N2F2可能的结构式;
-
(4) 三氟化硼乙醚(如图1)的熔点为-58℃,沸点为126~129℃,它属于晶体.
-
(5) 氟化钙的晶胞结构如图2所示,晶胞参数α=0.555pm.
①Ca2+、F-的配位数分别为和;
②列式表示氟化钙晶体的密度g•cm-3(不必计算出结果)。
已知在元素周期表中,A、B均为前四周期主族元素,且A位于B的下一周期。某含氧酸盐X的化学式为ABO3。请回答:
-
(1) 若常温下B的单质为黄绿色气体。
①A在元素周期表中的位置是。
②下列说法正确的是(填代号)。
a.A单质的熔点比B单质的熔点低
b.A的简单离子半径比B 的简单离子半径大
c.A、B元素的最高价氧化物对应的水化物都是强电解质
d.化合物X中既含有离子键又含有共价键
③400℃时,X能发生分解反应生成两种盐,其物质的量之比为1∶3,其中一种是无氧酸盐。该反应的化学方程式为。
-
(2) 若X能与稀硫酸反应,生成无色、无味的气体。
①该气体分子的电子式为。
②X在水中持续加热,发生水解反应,生成一种更难溶的物质并逸出气体,反应的化学方程式为。
③X可用作防火涂层,其原因是:a.高温下X发生分解反应时,吸收大量的热;
b. (任写一种)。
-
(3) 若X难溶于水,在空气中易氧化变质,B元素原子的最外层电子数是其电子层数的2倍。X能快速消除自来水中的ClO- , 该反应的离子方程式为。
-
(4) 用一个化学方程式证明上述(1)、(3)两种情况下化合物X中B元素非金属性强弱。
W、X、Y、Z是周期表中前20号的主族元素,原子序数依次增大。W、X、Y的原子最外层电子数之和为13,X与Z同主族,实验室可用Z的最高价氧化物的水化物稀溶液检验W的最高价氧化物。下列说法正确的是( )
A . 失去电子能力:X>Z>W
B . 原子半径:Z>Y>X
C . W、X、Y、Z的最高正化合价依次为+4、+2、+7、+2
D . W与Y形成的化合物含有极性键,不含有非极性键
用化学用语表示NH3+HCl=NH4Cl中的相关微粒,其中正确的是( )
A . 中子数为8的氮原子:  N
B . HCl的电子式:
N
B . HCl的电子式:  C . CO2的结构式:O=C=O
D . Cl-的结构示意图:
C . CO2的结构式:O=C=O
D . Cl-的结构示意图: 
 N
B . HCl的电子式:
N
B . HCl的电子式: 
实验室中常用丁二酮肟来检验Ni2+ , 反应时形成双齿配合物.离子方程式如下:

下列说法错误的是( )
A . 基态Ni2+的电子排布式为1s22s22p63s23p63d8
B . 丁二酮肟分子中碳原子与氮原子的杂化方式均为sp2
C . 每个二(丁二酮肟)合镍(II)含有32个σ键
D . 二(丁二酮肟)合镍( II )的中心原子的配体数目和配位数均为4
二氧化硅晶体是立体网状结构,其晶体模型如图所示。下列有关二氧化硅晶体的说法正确的是( )

A . 二氧化硅晶体最小环上含有12个原子
B . 每个硅原子为4个最小环所共有
C . 从晶体结构可知,1molSiO2拥有2molSi-O键
D . SiO2晶体是由极性共价键与非极性共价键共同构成的
有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到淡黄色固态化合物,D为同周期内原子半径最小的元素,试根据以上叙述回答:
-
(1) 元素符号:A;B;C;D;
-
(2) D元素位于周期表中周期族。C2B2的电子式:,所含化学键为。
-
(3) AB2的电子式,写出AB2与C2B2反应的化学方程式。
-
(4) 画出B的原子结构示意图。
下列有关化学用语正确的是( )
A . 硫化钠电子式  B . Cl-的结构示意图
B . Cl-的结构示意图 C . CO2的电子式
C . CO2的电子式 D . 中子数为18的氯原子符号
D . 中子数为18的氯原子符号
 B . Cl-的结构示意图
B . Cl-的结构示意图 C . CO2的电子式
C . CO2的电子式 D . 中子数为18的氯原子符号
D . 中子数为18的氯原子符号
肼(N2H4)又称为联氨,熔、沸点分别为1.4℃、113.5℃,可用如下方法制备肼:CO(NH2)2+ClO- +2OH- =N2H4+Cl-+CO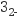 +H2O。下列有关说法正确的是( )
+H2O。下列有关说法正确的是( )
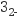 +H2O。下列有关说法正确的是( )
+H2O。下列有关说法正确的是( )
A . N2H4中只存在极性键
B . CO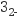 的空间构型为三角锥形
C . CO(NH2)2中C,N,O三种元素第一电离能大小顺序是:C<N<O
的空间构型为三角锥形
C . CO(NH2)2中C,N,O三种元素第一电离能大小顺序是:C<N<O
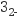 的空间构型为三角锥形
C . CO(NH2)2中C,N,O三种元素第一电离能大小顺序是:C<N<O
的空间构型为三角锥形
C . CO(NH2)2中C,N,O三种元素第一电离能大小顺序是:C<N<O
下列化学用语表示正确的是( )
A .  和
和 都是共价化合物
B .
都是共价化合物
B .  、
、 、
、 和
和 是氢元素的四种不同粒子
C .
是氢元素的四种不同粒子
C .  的电子式:
的电子式: D . 次氯酸的结构式:H-Cl-O
D . 次氯酸的结构式:H-Cl-O
 和
和 都是共价化合物
B .
都是共价化合物
B .  、
、 、
、 和
和 是氢元素的四种不同粒子
C .
是氢元素的四种不同粒子
C .  的电子式:
的电子式: D . 次氯酸的结构式:H-Cl-O
D . 次氯酸的结构式:H-Cl-O
反应 可用于制备火箭推进剂的燃料
可用于制备火箭推进剂的燃料 。下列有关说法正确的是( )
。下列有关说法正确的是( )
 可用于制备火箭推进剂的燃料
可用于制备火箭推进剂的燃料 。下列有关说法正确的是( )
。下列有关说法正确的是( )
A .  的结构式为
的结构式为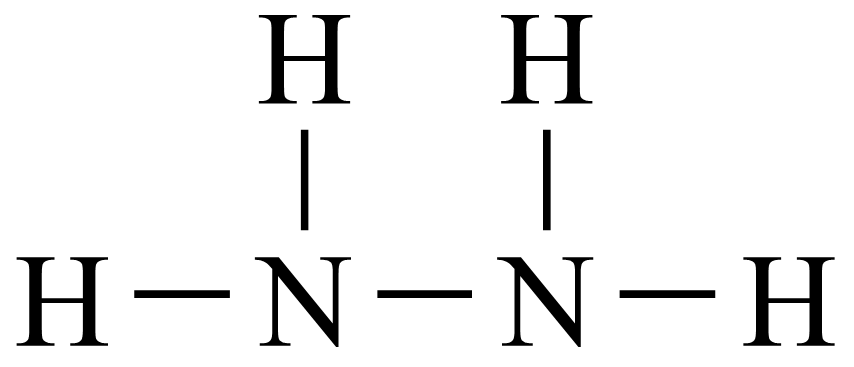 B . 中子数为8的氮原子可表示为
B . 中子数为8的氮原子可表示为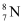 C . O基态原子的价层电子排布式为
C . O基态原子的价层电子排布式为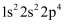 D . NaCl的电子式为
D . NaCl的电子式为
 的结构式为
的结构式为 B . 中子数为8的氮原子可表示为
B . 中子数为8的氮原子可表示为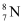 C . O基态原子的价层电子排布式为
C . O基态原子的价层电子排布式为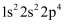 D . NaCl的电子式为
D . NaCl的电子式为
硼族元素(Boron group)指元素周期表中ⅢA 族所有元素,其中硼广泛应用于耐 高温合金工业。回答下列问题:
-
(1) 铊(Tl)是位于第 6 周期的硼族元素,其价电子轨道表示式为 ,原子序数为 。
-
(2) 晶体硼单质的基本结构单元为正二十面体,能自发呈现多面体外形,晶体氮化硼结 构类似于金刚石,其熔沸点比晶体硼 (填“高”或“低”),解释原因 。 第 2 周期元素中,第一电离能介于 N 和 B 之间的元素有 (填“元素符号”)。
-
(3) 硼酸晶体是片层结构,其中一层的结构如图所示(图中虚线表示氢键)。
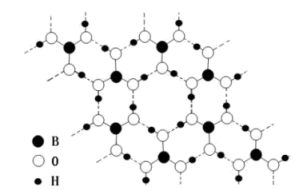
硼酸在冷水中的溶解度很小,在热水中较大,解释原因 , 1mol 硼酸晶体中含有氢键的数目为 。
-
(4) 硼氢化钠(NaBH4)是一种重要的储氢载体,该化合物中含有的化学键类型有 , 键角 H-B-H 为 ,其阴离子空间构型为 。
下列化学用语或模型表示正确的是( )
A . 乙烯的结构简式:CH2CH2
B . 甲烷分子的空间填充模型 C . S2-的结构示意图:
C . S2-的结构示意图: D . 羟基的电子式
D . 羟基的电子式
 C . S2-的结构示意图:
C . S2-的结构示意图: D . 羟基的电子式
D . 羟基的电子式最近更新



