科学探究的实验技能 知识点题库
实验编号 | 1 | 2 | 3 | |
稀硫酸的质量分数 | 10% | 10% | 20% | |
溶液温度/℃ | 反应前 | 20 | 30 | 20 |
反应后 | 26 | 37 | 28 | |
反应所需时间 | 长 | 较短 | 较短 | |
-
(1) 分析实验数据可以得出锌与稀硫酸反应的快慢与 有关。
-
(2) 同学们发现3次实验过程中总是开始阶段产生气泡逐渐变快,一定时间后逐渐变慢至停止。根据实验数据分析,锌与稀硫酸反应开始阶段产生气泡变快的决定因素是 。
-
(3) 请你根据实验结果,分析硫在氧气中燃烧比在空气中燃烧剧烈的原因 。
 B .
B .  C .
C .  D .
D . 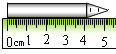
实验室现有氯酸钾、二氧化锰和稀盐酸,以及下列仪器.

(1)若利用上述仪器和药品制取氧气,反应的化学方程式为 ,应补充的一种仪器是(填仪器名称).
(2)若补充一种药品(填名称),并利用上述仪器和药品制取二氧化碳,你选择的仪器是 (填字母),添加药品前应进行的操作是 .

⑴提出问题:孑孓的生活需要空气吗?
⑵建立假设:;
⑶实验设计:
①取甲、乙两个大小相同的烧杯,放入等量清水:
②如图,取 40只孑孓放入甲烧杯中,并用一细密的铁丝网罩住(铁丝网会消耗水中空气),另取只孑孓放入乙烧杯中,甲烧杯在本实验中作为(填“实验组” 或“对照组”);
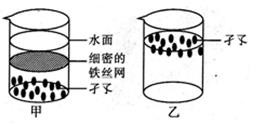
③将甲、乙两烧杯放在适合孑孓生活的同一环境中;
④观察甲、乙两烧杯中孑孓的生活情况; 该实验的变量是。
⑷什么实验现象可以证明孑孓的生活需要空气?。
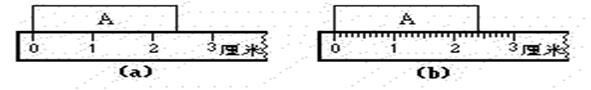
图(a)中,物体A长度为 , 图(b)中,物体A长度为.
 B . 加粉末状固体
B . 加粉末状固体  C . 滴液体
C . 滴液体  D . 闻气体
D . 闻气体 
【提出问题】草酸晶体受热分解产生了什么?
【猜想与假设】根据质量守恒定律,草酸晶体分解的产物中可能含水、CO或CO2。
【实验论证】研究小组设计了以下实验装置对上述猜想进行了探究。
信息提示:装置B为干燥管,其中的无水硫酸铜与水反应会变成蓝色。

-
(1) 如分解产物中存在一氧化碳,则实验现象为 。
-
(2) 该实验装置在设计上存在一个明显的错误,请你将其指出并改正:。
-
(3) 草酸晶体的熔点低,那么用试管作为反应容器组装的草酸晶体分解的实验发生装置要与通常不同的是:。
|
步骤 |
观察 |
现象 |
|
1 |
装置A |
亮绿色晶体变成白色和红棕色固体,玻璃管壁上有小水珠 |
|
2 |
装置B、F |
澄清石灰水均变浑浊 |
|
3 |
装置E |
固体变为红色 |

-
(1) C装置的作用是;
-
(2) 反应后将A中固体溶于水,过滤得到红棕色固体和无色溶液,在无色滤液加盐酸产生气泡,推测无色滤液可能含有;
-
(3) 三草酸合铁酸钾晶体分解产物有;
-
(4) 从实验安全角度考虑,图示装置还应采取的改进措施是。
【查阅资料】
⑴水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减小的方向进行。
⑵了解到某些难溶性盐的溶解能力和颜色,其中AgI是一种难溶于水的黄色沉淀。
【实验取证】取一支试管,加入少量AgNO3溶液,再加入过量NaCl溶液,有白色沉淀生成。再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀。
【分析讨论】
-
(1) 为什么要加入过量的NaCl溶液?说明理由。
-
(2) 写出加入少量KI溶液后发生反应的化学方程式。
-
(3) 该反应能发生的原因是AgI在水中的溶解能力AgCl(选填“大于”、“等于”或“小于”)。

-
(1) 在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是 。
-
(2) 第②步操作的目的是除去粗盐中的(填化学式,下同),第⑥步操作的目的是除去滤液中。
-
(3) 第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、 (填化学式)。
-
(4) 在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是 。
 B . 稀释浓硫酸
B . 稀释浓硫酸  C . 使用测电笔
C . 使用测电笔  D . 滴加溶液
D . 滴加溶液 步骤:在盛有2毫升水的试管中滴入3滴红墨水,振荡,然后加入2毫升酒精,不要振荡,发现酒精与水分层。
问题探究:
-
(1) 在水中滴入红墨水的目的是
-
(2) 在上述操作中,为了确保酒精与水有明显的分层现象,实验时应注意
【提出问题】蓝色溶液的溶质是什么?
【提出猜想】猜想一:CuSO4;猜想二:CuSO4 和 H2SO4。
-
(1) 【进行实验】取一定量反应后的溶液进行稀释,并分装在 A、B 两支试管中,然后进行下列实验,并完成如表:
步骤
实验操作
实验现象
实验结论
步骤一
在试管 A 中加入少量的 CuO 粉末
溶液中含有 H2SO4
步骤二
在试管B 中加入过量的NaOH 溶液
产生蓝色沉淀
溶液中含有 CuSO4
-
(2) 【探究结论】通过实验,猜想二正确。
写出步骤二中所发生反应的化学方程式:。
-
(3) 【反思评价】小明同学设计制取硫酸铜的两种方案:
方案一:铜和浓硫酸反应方程式:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O方案二:通过以下流程:

从环保角度,同学们认为:工业上不适宜用铜和浓硫酸反应来大量制取硫酸铜,理由是。
-
(4) 同学们继续通过计算分析制取硫酸铜的两种方案:
“方案一”硫酸和硫酸铜比为 196∶160;
“方案二”硫酸和硫酸铜比为 98∶160。
由此得出:制取相同质量硫酸铜所需的硫酸质量“方案一”是“方案二”两倍,所以采用“方案二”更节约原料。同学们的分析得到了老师的肯定和赞许,老师说实际上用“方案一”制取相同质量硫酸铜所需的硫酸质量远大于“方案二”两倍。请你帮助分析说明理由:。
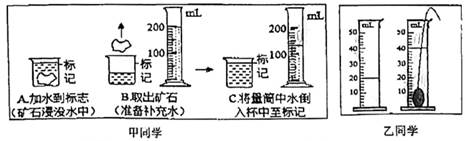
-
(1) 甲同学按照从A到C的操作过程,将使所测矿石体积结果如何(选填“偏大”、“偏小”、“不变”)并说明原因.
-
(2) 乙同学足先在量筒里注入适量的水,记下水的体积V1 , 然后轻轻放入石块,使量筒里的水完全浸没石块,记下此时水及石块的体积V2计算石块的体积为V2-V1。根锯右上图所示量筒和小石块,能测出小石块体积的“适量的水”的可能有( )A . 10毫升 B . 20毫升 C . 25毫升 D . 35毫升
-
(3) 为了让石块的体积测量结果更准确,你还可以做什么?

【提出问题】烧杯D中上层清液含有哪些溶质(除指示剂外)?
【分析讨论】小组讨论后认为,确定反应后物质成分的思维路径:
①考虑反应物用量的不同;②抓住化学反应的本质,即微粒的重组。
某小组同学分析过程笔记如下:

【初步结论】
-
(1) 通过分析确定:烧杯D上层清夜中肯定不含H+ , 肯定含有Na+、Cl-。判断一定含有Na+、Cl-的依据是;
-
(2) 【实验探究】
小组按如下方案进行实验探究
实验
实验内容
实验现象
实验结论
Ⅰ
取少量上层清液于试管中,加入过量碳酸钠溶液,静置。
无沉淀,溶液呈红色
肯定没有Ca2+
Ⅱ
取少量上层清液于试管中,加入过量“?”溶液,静置。
有白色沉淀,溶液呈红色
肯定有OH-、CO32-
根据实验Ⅰ可以初步推断:上层清液中溶质(除指示剂外)所有可能的组成(用化学式表示);
-
(3) 实验Ⅱ中应加入过量的溶液。
【实验结论】烧杯D中上层清液的溶质有指示剂、氯化钠、氢氧化钠、碳酸钠。



