物质除杂或净化 知识点题库
(1)铝是地壳中含量最多的金属元素,在元素周期表中铝元素的信息如图所示:
①铝的原子结构示意图为 ;
②铝离子的核外电子数为 ;
③工业上用电解熔融的方法冶炼铝,化学方程式为:2Al2O3 4Al+3O2↑ ,该反应属于基本反应类型中的 .
4Al+3O2↑ ,该反应属于基本反应类型中的 .
(2)要除去下列混合物中的杂质(括号内为杂质),写出除去杂质的化学方程式:
①Ag(Cu) ;②CO2(CO) .

-
(1) 若要确定C中收集的气体中有没有CO2 , 应该在下图中气体通入C装置之前添加一个盛有的检验装置.

-
(2) 乙同学为了验证草酸的分解产物设计了四个方案,分别将混合气体(包括水蒸气)依次通过足量的下列试剂,你认为其中最合理的方案是 .A . 石灰水、灼热的氧化铜、无水硫酸铜、氢氧化钠溶液 B . 无水硫酸铜、氢氧化钠溶液、灼热的氧化铜、石灰水 C . 石灰水、无水硫酸铜、灼热的氧化铜、石灰水 D . 无水硫酸铜、石灰水、灼热的氧化铜、石灰水.
-
(1) 一棵20年的大树仅可加工成一千多双一次性筷子,从珍惜资源和保护环境方面请给大家提一条合理化的建议.
-
(2) 硫磺熏制的一次性筷子用水浸泡可降低SO2的含量,这说明SO2具有的物理性质是,为了研究SO2的性质,某同学做了如图所示的实验:集气瓶中收集的是SO2 , 瓶内导管上系着瘪气球,通过胶头滴管向瓶中滴加紫色石蕊试液振荡,发现试液变红、气球膨胀,说明SO2可以跟反应,化学方程式为.

选项 | 实验目的 | 试剂或方法 |
A | 鉴别FeCl3 , NaCl,NaOH,MgCl2四种溶液 | 不另加试剂 |
B | 鉴别CaCO3 , NaOH,NaCl,NH4NO3四种固体 | 水 |
C | 除去MgCl2溶液中少量的CuCl2 | 加入过量铁粉、充分反应、过滤 |
D | 除去N2中的少量O2 | 将气体缓缓通过灼热的铜网 |

实验过程中,先打开K通入一氧化碳再加热;装置A中固体质量不再减少后,停止加热,待装置A冷却到室温后关闭K,实验测得装置A中固体质量减少了ag,装置B中液体质量增加了bg.
回答下列问题:
-
(1) 仪器①的名称是;
-
(2) 能判断生成的二氧化碳全部被装置B吸收的依据是:装置B的质量增加且;
-
(3) 若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则a b(填“>”“=”或“<”);
-
(4) D处为收集尾气的装置,应选择装置(填“甲”“乙”或“丙”)
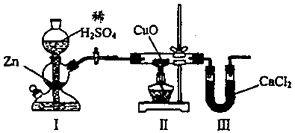

-
(1) 该粉末中一定不含有的物质是,操作Ⅰ的名称是,白色沉淀是。
-
(2) 加入试剂A要过量的原因是。
| 选项 | 实验目的 | 实验方法 |
| A | 检验一瓶气体是否为CO2 | 将燃着的木条伸入瓶中 |
| B | 鉴别H2和CH4 | 分别点燃,在火焰上方罩一干冷烧杯 |
| C | 鉴别石灰水和NaOH溶液 | 加入适量的稀盐酸 |
| D | 比较Zn、Cu、Ag的金属活动性 | 将Zn和Ag分别放入CuSO4溶液中 |
| 选项 | 实验目的 | 实验操作 |
| A | 鉴别H2和CH4 | 分别点燃,观察火焰颜色,并在火焰上方罩一干冷烧杯 |
| B | 除去MnO2中少量的KMnO4 | 加热固体混合物 |
| C | 检验一瓶气体是否为CO2 | 将燃着的木条伸入瓶中 |
| D | 分离CaCl2和CaCO3的固体混合物 | 加足量水溶解,过滤 |
|
选项 |
物质 |
操作方法 |
|
A |
Fe(Fe2O3) |
加入适量稀盐酸,充分反应后过滤 |
|
B |
CuSO4溶液(H2SO4) |
加入过量CuO粉末,加热,充分反应后过滤 |
|
C |
NaNO3(Na2SO4) |
加入过量的Ba(NO3)2溶液,充分反应后过滤 |
|
D |
NaOH溶液(Na2CO3溶液) |
加入适量的CaCl2溶液,充分反应后过滤 |
| 选项 | 待提纯的物质 | 选用试剂 |
| A | NaCl (Na2CO3) | 稀盐酸 |
| B | CaO (CaCO3) | 水 |
| C | CO2 (CO) | 石灰水 |
| D | MgCl2溶液(盐酸) | 氢氧化钠溶液 |
| 选项 | 物质(括号内为杂质) | 除杂试剂和方法 |
| A | Cu(Fe2O3) | 加入稀硫酸,过滤 |
| B | H2(水蒸气) | 通过浓硫酸,洗气 |
| C | NaOH溶液(Na2CO3) | 加入石灰水,过滤 |
| D | CaO(CaCO3) | 加入稀盐酸,过滤 |

-
(1) 请用管口小写字母标号表示装置连接的正确顺序(每种装置只能用一次)A→。
-
(2) B装置的作用是。
-
(3) 请设计实验证明,实验后装置D中溶液的溶质成分。(写出实验步骤、现象和结论)



