催化剂在化学反应中的作用 知识点题库
在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图.下列说法中不正确的是( )

A . A该反应为化合反应
B . 丙可能为该反应的催化剂
C . 参加反应的乙、丁质量比为3:2
D . 丁相对分子质量是甲的2倍
甲、乙、丙、丁四种物质,它们在密闭容器中反应前后质量的变化关系如下表所示.则下列说法错误的是( )
物质名称 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 40 | 10 | 10 | 0 |
反应后质量/g | 6 | M | 28 | 16 |
A . 甲是化合物
B . 乙可能是这个反应的催化剂
C . M=38
D . 此反应基本类型为分解反应
下列图象能正确反映其对应关系的是( )
A . 向等质量、等浓度的稀硫酸中分别加入过量的Zn和Fe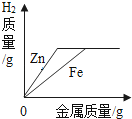 B . 向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸
B . 向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸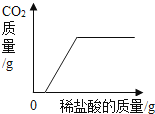 C . 用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气
C . 用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气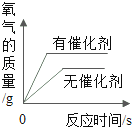 D . 一定温度时,向一定量的饱和石灰水中加入生石灰
D . 一定温度时,向一定量的饱和石灰水中加入生石灰
 B . 向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸
B . 向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸 C . 用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气
C . 用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气 D . 一定温度时,向一定量的饱和石灰水中加入生石灰
D . 一定温度时,向一定量的饱和石灰水中加入生石灰
下列图象与所叙述的化学原理不相符的是( )
A . t℃时向不饱和KNO3溶液中加入KNO3固体 B . 向盐酸中不断滴加氢氧化钾溶液
B . 向盐酸中不断滴加氢氧化钾溶液 C . 实验室用KClO3与MnO2共热制O2
C . 实验室用KClO3与MnO2共热制O2 D . 向盛有HNO3和Cu(NO3)2的溶液中加入NaOH溶液
D . 向盛有HNO3和Cu(NO3)2的溶液中加入NaOH溶液
 B . 向盐酸中不断滴加氢氧化钾溶液
B . 向盐酸中不断滴加氢氧化钾溶液 C . 实验室用KClO3与MnO2共热制O2
C . 实验室用KClO3与MnO2共热制O2 D . 向盛有HNO3和Cu(NO3)2的溶液中加入NaOH溶液
D . 向盛有HNO3和Cu(NO3)2的溶液中加入NaOH溶液
如图所示,实验室里有一套用来制取气体的装置,下列有关叙述正确的是( )

A . 锥形瓶里加入少量MnO2粉末,分液漏斗里盛放过氧化氢溶液,可以制取氧气
B . 锥形瓶里加入大理石,分液漏斗里盛放稀硫酸,可以制取二氧化碳
C . 当发生装置中液体与固体混合产生了气泡,立即开始收集气体
D . 集满氧气的集气瓶从水槽里取出后倒放在实验台上
下列有关催化剂的说法正确的是( )
A . 不使用催化剂,物质就不能发生化学反应
B . 催化剂只能加快反应速率
C . 催化剂能改变其它物质的反应速率
D . 用催化剂将水变成汽油
下列对催化剂的描述:①质量变小 ②质量不变 ③化学性质不变 ④化学性质改变⑤二氧化锰可作所有反应的催化剂,其中正确的是( )
A . ①③
B . ②③
C . ②③⑤
D . ③⑤
将氯酸钾和少量二氧化锰的混合物加热到没有气体放出时,在剩余的固体混合物中二氧化锰的质量分数与反应前相比( )
A . 没有改变
B . 增加了
C . 减少了
D . 无法确定
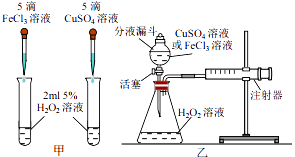
为比较FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行如下探究:
-
(1) 用图甲仪器和材料可定性比较FeCl3溶液和CuSO4溶液的催化效果,实验时还需要控制两溶液的相同。
-
(2) 图乙可定量比较FeCl3溶液和CuSO4溶液的催化效果,图乙装置中的注射器可用来。
-
(3) 实验结束后,小组同学继续深入探究。在FeCl3溶液催化反应过程中是哪种离子起催化作用?为研究这一问题,有同学取两支试管,各加入2mL5%的H2O2溶液,再分别加入等量、等浓度的FeCl3和HCl溶液,观察现象。在一支试管中加入HCl溶液的目的是为了排除对实验结果的干扰。
下列有关催化剂的说法正确的是( )
A . 在化学反应后其质量减小
B . 催化剂能改变化学反应速率
C . 在化学反应后其质量增加
D . 在化学反应后其化学性质发生了变化
将一种无色无味的液体A装入试管,将带火星的木条伸入试管,无现象,而向其中加入少量黑色粉末B后,迅速产生气泡,生成了能使带火星的木条复燃的气体C,使金属E红热并伸入盛有气体C且瓶底有少量液体D的集气瓶中,金属E剧烈燃烧,火星四射,生成黑色固体F。
-
(1) 写出它们的名称:
A.;B.;C.;D.;E.;F.。
-
(2) 黑色粉末B在A的分解反应中起作用,是这个反应的。
逻辑推理是化学学习常用的思维方法。某校研究性学习小组在做“寻找新的催化剂”课题时,发现将生锈的铁钉放到过氧化氢溶液中,也可以加快过氧化氢的分解速率。于是,他们对此展开探究:
⑴提出问题:什么物质是该反应催化剂?
⑵设猜想与假设:下面是组内两位同学所作的猜想,请你完成小华的猜想。
【假设一】小芳同学:铁钉表面的氧化铁是H2O2溶液分解反应的催化剂。
【假设二】小华同学:铁钉里的铁是H2O2溶液分解反应的催化剂。
⑶实验与结论:
|
实验操作 |
实验现象 |
实验结论 |
|
实验I:把一定质量的氧化铁粉末加入到装有10mL5%的过氧化氢溶液的试管中,并用一根带火星的小木条置于试管口,观察现象。 |
带火星木条复燃 |
假设一成立 |
|
实验Ⅱ:取10mL5%的过氧化氢溶液于另一支试管中,加入铁粉,并用一根带火星的小木条置于试管口,观察现象。 |
无现象 |
假设二 (填“成立”或“不成立”) |
⑷讨论交流:同学们讨论后认为,小芳的“实验I”还不能够确切的说明氧化铁就是过氧化氢分解制取氧气的催化剂,理由是。
⑸请设计实验证明氧化铁是催化剂的方法(写出实验步骤、实验现象及结论)
查阅资料发现,硫酸铜溶液是过氧化氢分解反应的催化剂。为了验证该信息并进一步探究硫酸铜溶液中起催化作用的粒子,小明进行了如下分析及实验。
-
(1) 验证硫酸铜溶液是过氧化氢分解反应的催化剂:除要确定硫酸铜溶液能加快过氧化氢的分解外,还需要验证在化学反应前后硫酸铜溶液的不变。
-
(2) 探究硫酸铜溶液中起催化作用的粒子的实验设计(已知H+对本实验无影响):
硫酸铜溶液中有三种粒子,其中的Cu2+、SO42-都可能起催化作用。
步骤一:在甲、乙两支试管中各加入5mL5%过氧化氢溶液;
步骤二: ;
步骤三:通过观察产生气泡的快慢得田结论。
-
(3) 工业上可用洗净的废铜屑作原料来制备硫酸铜。现有如下两种方法:
①Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O;②Cu
CuSO4+SO2↑+2H2O;②Cu  CuO
CuO 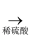 CuSO4。
CuSO4。小明认为方法②比方法①要好,请简述理由。(写出两点)
下列叙述与对应的坐标图表示正确的是( )
A . 向一定量的二氧化锰中加入过氧化氢溶液 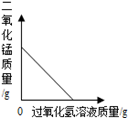 B . 等质量 CaCO3分别与等体积等质量分数的稀盐酸(足量)反应
B . 等质量 CaCO3分别与等体积等质量分数的稀盐酸(足量)反应  C . 等质量的Fe粉和Zn粉分别与足量等浓度的稀硫酸反应
C . 等质量的Fe粉和Zn粉分别与足量等浓度的稀硫酸反应 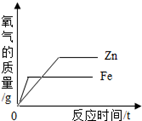 D . 向硝酸铜和硝酸的混合溶液中逐滴加入氢氧化钠溶液
D . 向硝酸铜和硝酸的混合溶液中逐滴加入氢氧化钠溶液 
 B . 等质量 CaCO3分别与等体积等质量分数的稀盐酸(足量)反应
B . 等质量 CaCO3分别与等体积等质量分数的稀盐酸(足量)反应  C . 等质量的Fe粉和Zn粉分别与足量等浓度的稀硫酸反应
C . 等质量的Fe粉和Zn粉分别与足量等浓度的稀硫酸反应  D . 向硝酸铜和硝酸的混合溶液中逐滴加入氢氧化钠溶液
D . 向硝酸铜和硝酸的混合溶液中逐滴加入氢氧化钠溶液 
氢能源是一种清洁可再生能源,能够与电能实现高效的相互转换,被视作是最具前景的能源之一,如图是一辆氢能源汽车的简易结构图。

-
(1) 制取氢气是氢能源利用领域的研究热点,可用铁酸锌(ZnFe2O4)作为催化剂分解水制取氢气,在该过程中,铁酸锌(ZnFe2O4)自身的 保持不变。
-
(2) 一辆氢能源汽车静止在水平地面上,对地面的压强为2×105帕,轮胎与地面的总接触面积为600厘米2 , 求这辆氢能源汽车的质量。(请列式计算)
如图是某化学反应的微观示意图。下列说法错误的是( )

A . 使用催化剂可改变该反应的速率
B . a 模型所代表的物质在大气中含量增加致使温室效应加剧
C . 反应前后原子和分子的数目均未改变
D . b 的化学式为 C2H4O2
诺贝尔化学奖的成果之一是对CO催化过程的研究,即一氧化碳在铂催化剂作用下的反应,这一过程可以表示为:① CO  COad , ② O2
COad , ② O2  2Oad , ③ COad + Oad→CO2(式中标有ad的表示吸附在金属铂表面的原子或分子),下列说法错误的是( )
2Oad , ③ COad + Oad→CO2(式中标有ad的表示吸附在金属铂表面的原子或分子),下列说法错误的是( )
A . 经过过程①②③后,铂的质量和化学性质都不变
B . 经过这个化学变化,碳元素的化合价发生改变
C . 一氧化碳在铂催化剂作用下发生的这个反应属于化合反应
D . 一氧化碳在铂催化剂作用下的反应原理可应用于汽车尾气处理,但会造成酸雨危害
在一密闭容器中,有甲、乙、丙、丁四种物质,反应前后各物质的质量如图所示。下列说法正确的是( )

A . 该反应为化合反应
B . 丙一定是该反应的催化剂
C . 甲、乙的相对分子质量之比一定为2:3
D . 反应过程中甲和丁变化的质量比为2 :1
科学家设计了“人造树叶”模拟光合作用,其装置和反应的微观示意图如图。下列说法错误的是( )

A . 该过程实现了能量的转化
B . 反应最终生成两种分子
C . 反应前后催化剂的化学性质不变
D . 该设计为缓解温室效应提供了新途径
一个密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得数据见表.下列说法中不正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量 | 8g | 35g | 5g | 8g |
| 反应后质量 | 2g | x | 5g | 42g |
A . x=7g
B . 在该反应中,丙物质一定为催化剂
C . 该反应类型是化合反应
D . 参加反应的甲物质的质量为6g
最近更新



