催化剂在化学反应中的作用 知识点题库
| 产品介绍 |
| “装饰树”表面涂了一层光触媒,是一种纳米级二氧化钛原料,能产生强烈的降解功能,能有效降解空气中的有毒有害气体,如甲醛、一氧化氮、二氧化硫、一氧化碳等。在降解过程中光触媒不挥发,不消耗,具有长效性。 |
-
(1) 由产品介绍可判断降解反应中二氧化钛是一种 (选填“反应物”、“生成物”或“催化剂”)。
-
(2)
如图是某科研小组探究两代光触媒降解一氧化氮的实验结果,由此可知:
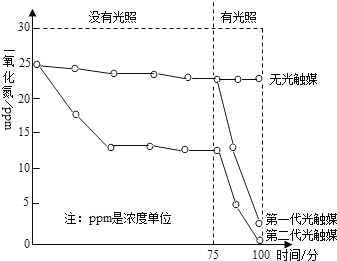
①第一代光触媒产生强烈的降解作用的条件是 。②第二代光触媒与第一代光触媒相比,优点是 (写出一点即可)。
物质 | X | Y | Z | W |
反应前质量/g | 10 | 3 | 90 | 0 |
反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 2 | 8 | 30 | 50 |
反应后质量/g | 20 | 待测 | 46 | 16 |
关于反应2KClO3 2KCl+3O2↑的说法,错误的是( )
2KCl+3O2↑的说法,错误的是( )
 一定量的稀硫酸中加入锌粒
B .
一定量的稀硫酸中加入锌粒
B .  向pH=1的溶液中加水
C .
向pH=1的溶液中加水
C .  加热KClO3和MnO2的混合物制O2
D .
加热KClO3和MnO2的混合物制O2
D .  一定量的CuSO4溶液中加NaOH溶液
一定量的CuSO4溶液中加NaOH溶液
被称之为“软电池”的纸质电池,采用薄层纸片作为传导体,电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH),避免了传统电池所带来的污染问题,因而废旧的纸质电池可作为一般的废弃物加以处理.下列说法错误的是( )

实验序号 | KClO3质量 | 加入其它的物质 | 待测数据 |
1 | 1.2g | 无其它物质 | |
2 | 1.2g | 加入少量的CuO |
-
(1) 上述实验中的“待测数据”指.
-
(2) 从如图仪器中选择合适的并加以组装

-
(3) 为探究CuO在实验2中是否起催化作用,还需探究的氧化铜的在化学反应前后不变.其反应的文字表达式为.
-
(1) 为探究催化剂的种类对氯酸钾分解速度的影响,甲同学设计以下对比实验:
Ⅰ.将2.45g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将x g KClO3与1.0g CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢.通常采用的方法有:
①测相同时间内产生O2的体积
②测;
Ⅰ中反应的符号表达式是;
Ⅱ中x的值应为.
-
(2) 乙同学探究了影响双氧水分解速度的某种因素,实验数据记录如表:
双氧水的质量
双氧水的浓度
MnO2的质量
相同时间内
产生O2的体积
I
50.0g
1%
0.1g
9mL
II
50.0g
2%
0.1g
16mL
III
50.0g
4%
0.1g
31mL
【数据处理及结论】
I.本实验中,测量O2体积的装置是(选填图1中“a”“b”“c”编号).

II.实验结论:在相同条件下,双氧水分解速率越快.
III.丙用如图2装置进行实验,通过比较也能达到实验目的,写出锥形瓶中发生反应的符号表达式.
资料1:2KMnO4 + 5 H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 8H2O + 10CO2↑
资料2:通常情况下,反应物浓度变大,反应加快;温度升高,反应加快。
-
(1) 根据这些资料,小明提出了两个假设。
假设一:褪色速度突然加快是由反应物浓度变大引起的;
假设二:褪色速度突然加快是由反应过程中温度升高引起的;
小明经过分析,否定了假设一,理由是。
-
(2) 小丽针对假设二进行实验探究后,经过思考,又做了如下实验:
把经过硫酸酸化的高锰酸钾溶液等分为两份,分装A、B两试管,同时向两支试管中加入等量等浓度的草酸溶液,并置于同一水浴中。迅速向A试管中加入一定量的MnSO4 , 发现A试管中溶液褪色明显快于B试管。上述实验中,把2支试管置于用一水浴中的目的是。这一实验基于的假设是。
| 选项 | 操作 | 现象 | 结论 |
| A | 用浓硫酸在白纸上写字 | 白纸变黑甚至穿孔 | 浓硫酸有强烈的吸水性 |
| B | 在灼热的CuO中通入CO | 黑色粉末变成红色 | CO具有还原性 |
| C | 在装双氧水的试管中加MnO2 | 有大量气泡产生 | 该反应的反应物是H2O2和MnO2 |
| D | 在CuSO4溶液中分别插入铁片和银片 | 银表面有红色物质析出;铁片无变化 | 金属活动性顺序:Ag>Cu>Fe |
| 序号 | 化学反应事实 | 影响化学反应的因素 |
| A | 铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧 | 反应物浓度 |
| B | 碳在常温下不与氧气反应,而在点燃时能与氧气反应 | 反应温度 |
| C | 双氧水在常温下较难分解,而在加入二氧化锰后迅速分解 | 催化剂 |
| D | 铜片在空气中很难燃烧,铜粉在空气中较易燃烧 | 反应物的状态 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用小木条蘸少量浓硫酸 | 小木条变成黑色 | 浓硫酸具有吸水性 |
| B | 向紫色石蕊试液中通入CO2气体 | 溶液变成红色 | 不能说明CO2与水反应 |
| C | 向盛有红棕色NO2气体的集气瓶中加入活性炭 | 红棕色消失 | 碳与NO2发生化学反应 |
| D | 向H2O2溶液中加入少量MnO2粉末 | 产生大量气体 | MnO2是该反应的催化剂 |

【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】他以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
|
实验序号 |
KClO3质量 |
其他物质质量 |
待测数据 |
|
① |
1.2g |
/ |
|
|
② |
1.2g |
CuO 0.5g |
|
|
③ |
1.2g |
MnO2 0.5g |
-
(1) 上述实验应测量的“待测数据”是
-
(2) 若实验②比实验①的“待测数据”更 (填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。
-
(3) 将实验②反应后的固体加水溶解、过滤、洗涤、干燥,称量仍得到0.5g氧化铜,若要验证氧化铜是该反应的催化剂,还需验证氧化铜的不变。
【预期结论】氧化铜也能作氯酸钾的催化剂。
【评价设计】你认为小雨设计实验③和实验②对比的目的是。
 CuSO4+H2O,生成的硫酸铜溶液呈蓝色,实验步骤:
CuSO4+H2O,生成的硫酸铜溶液呈蓝色,实验步骤: 
①如图连接装置,字母a所示仪器的名称是__________。
②向锥形瓶中加入二氧化锰粉末,加入10%的双氧水,观察现象并记录相关数据如表。
| 物质 | 质量/g | 10%双氧水体积/mL | 集满一瓶氧气所用时间/s |
| 二氧化锰 | 0.5 | 20 | 25 |
| 氧化铜 | ________ | 20 | 38 |
③清洗并干燥装置,换用氧化铜粉末重复步骤②,相关数据记录表中,据此分析:
-
(1) 步骤①中名称。小金通过比较来判断两种物质催化效果的强弱;
-
(2) 步骤③中所加氧化铜的质量是;
-
(3) 可得出的结论是;
-
(4) 小徐同学分析了小金的实验过程后,认为还需要补做几个实验步骤,才能证明氧化铜在该反应中是催化剂。步骤继续设计如下:
④将反应结束后剩余氧化铜固体进行过滤、洗涤、干燥并(填写操作名称),证明氧化铜在反应前后质量未发生变化;
⑤向上一步所得固体中加入稀硫酸并微热,观察溶液颜色,证明氧化铜在反应前后未发生变化。



