ж №жҚ®еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸзҡ„и®Ўз®— зҹҘиҜҶзӮ№йўҳеә“
е·ҘдёҡеҲ¶еҸ–зўій…ёй’ еёёдјҡеҗ«жңүе°‘йҮҸзҡ„ж°ҜеҢ–й’ пјҺе®һйӘҢжҺўз©¶е°Ҹз»„ж¬ІжөӢе®ҡзўій…ёй’ ж ·е“Ғдёӯзўій…ёй’ зҡ„иҙЁйҮҸеҲҶж•°пјҢеҸ–иҜҘж ·е“Ғ11gеҠ е…Ҙ64.4gж°ҙеҪўжҲҗдёҚйҘұе’Ңжә¶ж¶ІпјҢ然еҗҺеҗ‘е…¶дёӯеҠ е…ҘдёҖе®ҡйҮҸзҡ„зЁҖзӣҗй…ёпјҢжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢжүҖеҫ—жә¶ж¶Ізҡ„жә¶иҙЁиҙЁйҮҸеҲҶж•°10%пјҺдә§з”ҹдәҢж°§еҢ–зўізҡ„иҙЁйҮҸдёҺж—¶й—ҙзҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҡ
пјҲ1пјүжұӮиҜҘж ·е“Ғдёӯзўій…ёй’ зҡ„иҙЁйҮҸеҲҶж•°пјҺпјҲз»“жһңзІҫзЎ®еҲ°0.1%пјү
пјҲ2пјүжұӮжҒ°еҘҪе®Ңе…ЁеҸҚеә”ж—¶жүҖеҠ зЁҖзӣҗй…ёзҡ„иҙЁйҮҸпјҺ

з”ІгҖҒд№ҷдёӨзғ§жқҜеҶ…зӣӣжңүзӯүиҙЁйҮҸгҖҒзӯүиҙЁйҮҸеҲҶж•°зҡ„зӣҗй…ёпјҺе°Ҷй•ҒйҖҗжёҗеҠ е…Ҙз”Ізғ§жқҜпјҢй“ҒйҖҗжёҗеҠ е…Ҙд№ҷзғ§жқҜпјҢжөӢйҮҸеҠ е…Ҙзҡ„йҮ‘еұһиҙЁйҮҸmе’Ңзӣёеә”зҡ„зғ§жқҜеҶ…зү©иҙЁиҙЁйҮҸеҸҳеҢ–йҮҸв–іmпјҢз”»еҮәв–іMп№ЈmжӣІзәҝoacе’Ңobcзҡ„зӨәж„ҸеӣҫпјҢеҰӮеӣҫжүҖзӨәпјҺж №жҚ®еӣҫдёӯдҝЎжҒҜпјҢдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү 
еңЁеҒҡе®ҢвҖңз”ЁзЁҖзӣҗй…ёе’ҢзҹізҒ°зҹіеҸҚеә”еҲ¶еҸ–дәҢж°§еҢ–зўівҖқзҡ„е®һйӘҢеҗҺпјҢе°ҸжҳҺзӘҒ然жғіеҲ°пјҡжҳҜеҗҰеҸҜд»ҘжөӢеҫ—е®һйӘҢжүҖз”Ёзҡ„зҹізҒ°зҹідёӯзўій…ёй’ҷзҡ„еҗ«йҮҸе‘ўпјҹе°ҸжҳҺеҸҲиҝӣиЎҢдәҶеҰӮдёӢе®һйӘҢпјҡ
в‘ е°ҶиҜ•з®ЎдёӯеҸҚеә”зҡ„еү©дҪҷзү©иҝҮж»Ө并еӨҡж¬Ўз”Ёи’ёйҰҸж°ҙжҙ—ж¶ӨпјҢеҫ—еҲ°ж»Өж¶Іе’Ңж»ӨжёЈпјҺ
в‘Ўеҗ‘ж»ӨжёЈдёӯж»ҙеҠ зЁҖзӣҗй…ёпјҢж— жҳҺжҳҫзҡ„зҺ°иұЎпјҺ
в‘ўе°Ҷж»ӨжёЈе№ІзҮҘеҗҺз§°йҮҸпјҢиҙЁйҮҸдёә0.5gпјҺ
в‘Јеҗ‘ж»Өж¶ІдёӯеҠ е…ҘдёҖе®ҡ10%зҡ„Na2CO3жә¶ж¶ІпјҢиҺ·еҫ—дәҶзӣёе…ізҡ„ж•°жҚ®пјҢ并з»ҳеҲ¶жҲҗеҰӮеӣҫжүҖзӨәзҡ„еӣҫиұЎпјҺж №жҚ®е°ҸжҳҺзҡ„е®һйӘҢиҝҮзЁӢеӣһзӯ”дёӢеҲ—й—®йўҳпјҺпјҲеҒҮи®ҫзҹізҒ°зҹідёӯзҡ„е…¶дҪҷжқӮиҙЁдёҚдёҺзЁҖзӣҗй…ёеҸҚеә”пјү

-
пјҲ1пјү еңЁNa2CO3жә¶ж¶ІеҠ еҲ°еӣҫиұЎдёӯжҳҫзӨәзҡ„aзӮ№ж—¶пјҢжә¶ж¶ІдёӯжүҖеҗ«зҡ„жә¶иҙЁдёәпјҺ
-
пјҲ2пјү 第②жӯҘдёӯе°ҸжҳҺеҗ‘ж»ӨжёЈдёӯеҠ е…ҘзЁҖзӣҗй…ёзҡ„зӣ®зҡ„жҳҜдёәдәҶпјҺ
-
пјҲ3пјү ж №жҚ®еӣҫиұЎеҸҠзӣёе…ізҡ„ж•°жҚ®еҸҜжұӮеҫ—зҹізҒ°зҹідёӯзўій…ёй’ҷзҡ„иҙЁйҮҸеҲҶж•°пјҺ
-
пјҲ4пјү 第①жӯҘдёӯеҰӮжһңеңЁиҝҮж»Өж—¶жІЎжңүз”Ёи’ёйҰҸж°ҙеӨҡж¬Ўжҙ—ж¶ӨпјҢеҲҷжөӢеҫ—зўій…ёй’ҷзҡ„иҙЁйҮҸеҲҶе°ҶпјҺпјҲйҖүеЎ«вҖңеҒҸеӨ§вҖқгҖҒвҖңдёҚеҸҳвҖқжҲ–вҖңеҒҸе°ҸвҖқпјү
е®һйӘҢеәҸеҸ· | жё©еәҰпјҲв„ғпјү | еӨ§зҗҶзҹійў—зІ’ | зӣҗй…ёиҙЁйҮҸеҲҶж•°пјҲ%пјү | е®һйӘҢзӣ®зҡ„ |
1 | 20 | зІ— | 5 | жҺўз©¶еӨ§зҗҶзҹіе’Ңзӣҗй…ёзҡ„еҸҚеә”йҖҹеәҰдёҺзҹізҒ°зҹійў—зІ’еӨ§е°Ҹзҡ„е…ізі» |
2 | 20 | з»Ҷ | 5 |
-
пјҲ1пјү
дёәдәҶжҜ”иҫғеҸҚеә”йҖҹеәҰпјҢи®ҫи®ЎеҰӮеӣҫдёҖжүҖзӨәиЈ…зҪ®пјҢе…¶дёӯйҮҸзӯ’зҡ„дҪңз”ЁжҳҜпјӣ

-
пјҲ2пјү дёӨж¬Ўе®һйӘҢдёӯдә§з”ҹCO2дҪ“з§ҜйҡҸж—¶й—ҙзҡ„еҸҳеҢ–е…ізі»еҰӮеӣҫдәҢжүҖзӨәпјҢиҜ·з»“еҗҲжүҖеӯҰзҡ„зҹҘиҜҶеҜ№дёӨж¬Ўе®һйӘҢзҡ„жӣІзәҝдҪңеҮәеҗҲзҗҶзҡ„и§ЈйҮҠгҖӮ.
-
пјҲ3пјү е·ІзҹҘ20в„ғиҜҘж°”еҺӢдёӢCO2ж°”дҪ“еҜҶеәҰзәҰ1.98 g/LпјҢжұӮеӨ§зҗҶзҹідёӯCaCO3зҡ„иҙЁйҮҸгҖӮ
ж¬Ўж•° | е®һйӘҢеүҚ | 第1ж¬Ў | 第2ж¬Ў |
еҠ е…ҘзЁҖзЎ«й…ёзҡ„иҙЁйҮҸ/g | 0 | 50 | 50 |
еү©дҪҷеӣәдҪ“зҡ„иҙЁйҮҸ/g | 5 | 3 | 2 |
пјҲе·ІзҹҘпјҡй“ңдёҚе’ҢзЁҖй…ёеҸҚеә”пјҢзЎ«й…ёй”ҢеҸҜжә¶дәҺж°ҙпјү
ж—¶й—ҙ/s | 0 | 20 | 40 | 60 | 80 | 100 |
зғ§жқҜдёҺжүҖзӣӣзү©иҙЁиҙЁйҮҸ/g | 174.0 | 171.0 | 169.0 | 168.0 | 167.4 | 167.4 |
и®Ўз®—пјҡ
-
пјҲ1пјү з”ҹжҲҗдәҢж°§еҢ–зўізҡ„иҙЁйҮҸпјҺ
-
пјҲ2пјү иҜҘеӨ§зҗҶзҹідёӯзўій…ёй’ҷзҡ„иҙЁйҮҸеҲҶж•°пјӣ
-
пјҲ3пјү еҸҚеә”е®ҢжҲҗжүҖеҫ—жә¶ж¶Ідёӯжә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°пјҲзІҫзЎ®еҲ°0.1%пјү
-
пјҲ1пјү ж–№и§Јзҹізҡ„еӨұйҮҚзҷҫеҲҶжҜ”пјӣ
-
пјҲ2пјү и®Ўз®—зҹҝзү©дёӯй«ҳеІӯзҹізҡ„иҙЁйҮҸеҲҶж•°гҖӮ
в‘ з”ІеҗҢеӯҰз”Ёе°Ҷж ·е“ҒеҠ зғӯпјҢеү©дҪҷеӣәдҪ“зҡ„иҙЁйҮҸдёҺеҠ зғӯж—¶й—ҙзҡ„е…ізі»еҰӮиЎЁжүҖзӨәпјҡ
еҠ зғӯж—¶й—ҙ/min | t0 | t1 | t2 | t3 | t4 | t5 |
еү©дҪҷеӣәдҪ“иҙЁйҮҸ/g | 12 | 12 | 11 | 8 | 6.6 | 6.6 |
в‘Ўд№ҷеҗҢеӯҰе°ҶдёҖд»Ҫж”ҫдәҺзғ§жқҜдёӯпјҢеҗ‘зғ§жқҜдёӯйҖҗжёҗеҠ е…ҘжҹҗдёҖжө“еәҰзҡ„зӣҗй…ёпјҢеҸҚеә”иҝҮзЁӢжөӢеҫ—еү©дҪҷеӣәдҪ“иҙЁйҮҸдёҺеҠ е…Ҙзӣҗй…ёзҡ„иҙЁйҮҸе…ізі»еҰӮеӣҫ(a)жүҖзӨәпјҡ
в‘ўдёҷеҗҢеӯҰиҝӣиЎҢеҰӮеӣҫ(b)жүҖзӨәзҡ„е®һйӘҢпјҡжҠҠдә§з”ҹзҡ„CO2ж°”дҪ“з”Ёи¶ійҮҸзҡ„зғ§зўұжә¶ж¶Іеҗёж”¶пјҢеҗҢж—¶жөӢйҮҸB瓶зғ§зўұжә¶ж¶ІеўһеҠ зҡ„иҙЁйҮҸпјҢз»“жһңеҰӮдёӢиЎЁжүҖзӨәпјҡ
ж—¶й—ҙ/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
B瓶еўһеҠ зҡ„иҙЁйҮҸ/g | 0 | 2 | 3 | 4 | 4.6 | 4.6 | 4.6 |
-
пјҲ1пјү з”ІеҗҢеӯҰеңЁжӯӨжөӢе®ҡиҝҮзЁӢдёӯжңүдёӨдёӘж—¶й—ҙж®өеӣәдҪ“зҡ„иҙЁйҮҸйғҪжІЎжңүж”№еҸҳпјҢеҲҷеңЁt0иҮіt1ж—¶й—ҙж®өпјҢеӣәдҪ“иҙЁйҮҸдёҚеҸҳзҡ„еҺҹеӣ жҳҜ гҖӮ
-
пјҲ2пјү д№ҷеҗҢеӯҰеңЁе®һйӘҢдёӯеҫ—еҲ°зҡ„дәҢж°§еҢ–зўізҡ„иҙЁйҮҸжңүеӨҡе°‘пјҹ(еҶҷеҮәи®Ўз®—иҝҮзЁӢ)
-
пјҲ3пјү з»ҸиҝҮз”ІгҖҒд№ҷгҖҒдёҷеҗҢеӯҰзҡ„и®Ўз®—пјҢеҸ‘зҺ°дёҷеҗҢеӯҰжөӢеҫ—зўій…ёй’ҷиҙЁйҮҸеҲҶж•°жҳҺжҳҫеҒҸеӨ§пјҢиҜ·дҪ еҲҶжһҗе…¶дёӯзҡ„еҺҹеӣ пјҡгҖӮ

-
пјҲ1пјү жҒ°еҘҪе®Ңе…ЁеҸҚеә”ж—¶ж¶ҲиҖ—Na2SO4жә¶ж¶Ізҡ„иҙЁйҮҸжҳҜеӨҡе°‘е…Ӣпјҹ
-
пјҲ2пјү жҒ°еҘҪе®Ңе…ЁеҸҚеә”ж—¶жүҖеҫ—жә¶ж¶Ідёӯжә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°жҳҜеӨҡе°‘пјҹ(еҶҷеҮәи®Ўз®—жӯҘйӘӨпјҢи®Ўз®—з»“жһңзІҫзЎ®еҲ°0.1%)

в‘ иҜ•еүӮXеҸҜд»ҘжҳҜзЁҖзЎ«й…ё
в‘ЎеӣәдҪ“YеҸҜд»ҘжҳҜз”ҹзҹізҒ°
в‘ўж»ҙеҠ иҜ•еүӮXеүҚй”ҘеҪўз“¶еҶ…ж°ҙзҡ„иҙЁйҮҸдёә0.9g
в‘ЈиӢҘжІЎжңүзҗғеҪўе№ІзҮҘз®ЎпјҢжөӢеҫ—ж°ўж°§еҢ–й’ еӣәдҪ“д»Һз©әж°”дёӯеҗёж”¶ж°ҙзҡ„иҙЁйҮҸдјҡеҒҸе°Ҹ
 B .
B .  C .
C .  D .
D . 

-
пјҲ1пјү е·ІзҹҘж°ўж°”зҡ„еҜҶеәҰжҜ”з©әж°”е°ҸпјҢйҡҫжә¶дәҺж°ҙгҖӮеә”йҖүжӢ©з”Іеӣҫдёӯзҡ„иЈ…зҪ®иҝӣиЎҢеҲ¶еҸ–е’Ң收йӣҶгҖӮ
-
пјҲ2пјү д№ҷеӣҫдёәжЈҖжҹҘеҸ‘з”ҹиЈ…зҪ®ж°”еҜҶжҖ§зҡ„ж“ҚдҪңпјҢеҪ“и§ӮеҜҹеҲ°ж°ҙдёӯзҡ„еҜјз®ЎеҸЈжңүдә§з”ҹпјҢеҲҷиЎЁзӨәиҜҘиЈ…зҪ®ж°”еҜҶжҖ§иүҜеҘҪгҖӮ
-
пјҲ3пјү е·ІзҹҘж°ўж°”зҡ„еҜҶеәҰдёә 0.09 е…Ӣ/еҚҮпјҢиҜ·и®Ўз®—иғҪ收йӣҶеҲ°еӨҡе°‘еҚҮж°ўж°”гҖӮ(и®Ўз®—з»“жһңзІҫзЎ®еҲ° 0.01%)
-
пјҲ4пјү еҸҚеә”з»“жқҹеҗҺпјҢеҸ‘зҺ°е®һйҷ…收йӣҶеҲ°зҡ„ж°”дҪ“дҪ“з§ҜжҜ”и®Ўз®—еҖјиҰҒеӨ§пјҢиҜ·еҲҶжһҗеҸҜиғҪеҺҹеӣ (еҶҷеҮәдёӨзӮ№)гҖҒгҖӮ
-
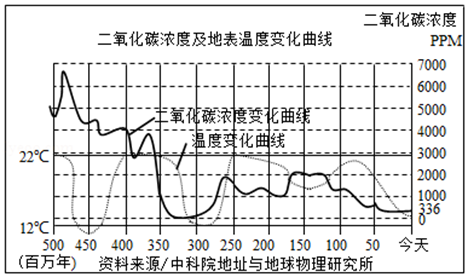
пјҲ1пјү жңүдәәи®ӨдёәпјҢе…Ёзҗғж°”еҖҷеҸҳжҡ–жҳҜдәҢж°§еҢ–зўізӯүжё©е®Өж°”дҪ“иҝҮеәҰжҺ’ж”ҫжүҖйҖ жҲҗзҡ„гҖӮд»Һиҫғй•ҝзҡ„еҺҶеҸІж—¶жңҹжқҘзңӢпјҢжғ…еҶөеҰӮеҸіеӣҫжүҖзӨәгҖӮеҲҶжһҗеӣҫдёӯж•°жҚ®еҸҜд»Ҙеҫ—еҮәзҡ„и§ӮзӮ№жңү гҖӮA . зӣ®еүҚдәҢж°§еҢ–зўіжө“еәҰдҪҺдәҺеҺҶеҸІеӨ§йғЁеҲҶж—¶еҖҷ B . дәҢж°§еҢ–зўіжө“еәҰдёҺж°”жё©дёҠеҚҮдёҚжҲҗжӯЈжҜ” C . дәҢж°§еҢ–зўіжҳҜйҖ жҲҗж°”жё©дёҠеҚҮзҡ„е”ҜдёҖеҺҹеӣ D . дәәзұ»жҺ’ж”ҫдәҢж°§еҢ–зўіеҝ…е®ҡйҖ жҲҗзҒҫйҡҫжҖ§еҗҺжһң
-
пјҲ2пјү дәә们жҲ–и®ёдјҡй—®пјҡиҝҷдәӣзўіжқҘиҮӘдҪ•ж–№пјҹ
в‘ еҰӮжһңд»Ҙж°ҙеңҲгҖҒеӨ§ж°”еңҲгҖҒеІ©зҹіеңҲгҖҒз”ҹзү©еңҲдёәеҜ№иұЎжқҘиҖғйҮҸзўіеҫӘзҺҜпјҢеӨ§ж°”еңҲдёӯзҡ„дәҢж°§еҢ–зўідёҖйғЁеҲҶйҖҡиҝҮе…үеҗҲдҪңз”Ёеӣәе®ҡеңЁз”ҹзү©еңҲдёӯпјҢеҠЁжӨҚзү©зҡ„е‘јеҗёдҪңз”Ёе°ҶдёҖйғЁеҲҶзўійҮҠж”ҫеҲ°еӨ§ж°”еңҲдёӯпјҢдјҙйҡҸзқҖеҠЁжӨҚзү©зҡ„жӯ»дәЎпјҢдҪ“еҶ…зҡ„зўідёҖйғЁеҲҶиў«пјҲеЎ«жҹҗзұ»з”ҹзү©пјүеҲҶи§ЈпјҢиҝ”еӣһеӨ§ж°”еңҲгҖӮ
в‘ЎжҠҠең°зҗғеҸҠе…¶еӨ§ж°”еұӮдҪңдёәдёҖдёӘж•ҙдҪ“жқҘзңӢпјҢзўіе…ғзҙ зҡ„жҖ»иҙЁйҮҸгҖӮ
-
пјҲ3пјү ж ҮеҮҶзҠ¶еҶөдёӢпјҢең°зҗғиЎЁйқўзҡ„еӨ§ж°”дҪ“з§ҜзәҰдёә4.4Г—1018зұі3гҖӮиӢҘдәәзұ»йҖҡиҝҮдёҖж®өж—¶й—ҙзҡ„дҪҺзўіз”ҹжҙ»ж–№ејҸпјҢең°зҗғиЎЁйқўеӨ§ж°”дёӯзҡ„дәҢж°§еҢ–зўіжө“еәҰйҷҚдҪҺдәҶ0.5PPMпјҲ1PPMпјқ1е…Ӣ/зұі3пјүпјҢеҲҷең°зҗғиЎЁйқўеӨ§ж°”дёӯдәҢж°§еҢ–зўізҡ„иҙЁйҮҸзәҰеҮҸе°‘еӨҡе°‘еҚғе…ӢпјҹиҝҷдәӣдәҢж°§еҢ–зўіе…ЁйғЁиў«жӨҚзү©з”ЁдәҺе…үеҗҲдҪңз”ЁпјҢеҸҜд»ҘеҗҲжҲҗжңүжңәзү©пјҲд»ҘC6H12O6и®Ўпјүзҡ„иҙЁйҮҸдёәеӨҡе°‘пјҹ
е·ІзҹҘжӨҚзү©е…үеҗҲдҪңз”ЁеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡ6CO2+6H2O
 C6H12O6+6O2
C6H12O6+6O2 -
пјҲ4пјү дёҚи®ә科еӯҰз ”з©¶жңҖз»Ҳдјҡеҫ—еҮәд»Җд№Ҳз»“и®әпјҢдҪҺзўіз”ҹжҙ»д»ЈиЎЁзқҖдҪҺжҲҗжң¬гҖҒжӣҙеҒҘеә·зҡ„з”ҹжҙ»ж–№ејҸпјҢжҳҜеҖјеҫ—жҸҗеҖЎзҡ„гҖӮд»ҺдҪҺзўіз”ҹжҙ»зҡ„и§’еәҰпјҢжҲ‘们еә”иҜҘеӨҡеҗғзұ»йЈҹзү©гҖӮпјҲйҖүеЎ«вҖңеҠЁзү©вҖқжҲ–вҖңжӨҚзү©вҖқпјү
-
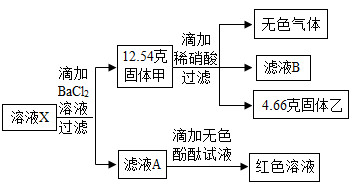
пјҲ1пјү иҝҮж»ӨдёӯзҺ»з’ғжЈ’зҡ„дҪңз”ЁжҳҜ гҖӮ
-
пјҲ2пјү дә§з”ҹзҡ„ж— иүІж°”дҪ“жҳҜ гҖӮ
-
пјҲ3пјү жә¶ж¶ІXзҡ„жә¶иҙЁжҳҜгҖӮ
-
пјҲ4пјү и®Ўз®—ж»Өж¶ІAдёӯж°ҜеҢ–й’ зҡ„иҙЁйҮҸгҖӮ
 B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
-
пјҲ1пјү еҸҚеә”з»“жқҹеҗҺпјҢиҝҮж»ӨпјҢжҙ—ж¶Ө并зғҳе№Іж»ӨжёЈпјҢз§°еҫ—ж»ӨжёЈзҡ„иҙЁйҮҸдёәgгҖӮ
-
пјҲ2пјү и®Ўз®—еҺҹиҝҮж°§еҢ–ж°ўжә¶ж¶Ідёӯжә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°гҖӮ


-
пјҲ1пјү е®һйӘҢдёӯзңӢеҲ°зҡ„зҺ°иұЎпјҡзҺ»з’ғз®Ўдёӯзҡ„зІүжң«гҖӮ
-
пјҲ2пјү з”Ё600еҗЁеҗ«ж°§еҢ–й“ҒиҙЁйҮҸеҲҶж•°дёә80%зҡ„иөӨй“ҒзҹҝпјҢеҸҜд»ҘзӮјеҮәеҗ«жқӮиҙЁ4%зҡ„з”ҹй“ҒеӨҡе°‘еҗЁпјҹпјҲеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә3CO+Fe2O3
 2Fe+3CO2пјү
2Fe+3CO2пјү



