结晶的原理、方法及其应用 知识点题库
右图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题。
(1)t1℃时,100g水中溶解20g甲,溶液刚好饱和;那么50g水中溶解 g乙,溶液刚好饱和。
(2)t2℃时,比较两物质的溶解度大小: 。
(3)t1℃时,若要将甲物质的饱和溶液变为不饱和溶液,可采用的方法是 (写一种即可)。
(4)若要从甲中含有少量乙的混合溶液中提纯甲,可用的方法是 。
如图甲、乙、丙三种固体物质的溶解度曲线,请回答下列问题.
(1)20℃时,三种物质的溶解度由大到小的顺序是 ;
(2)当乙中混有少量的甲时,可采用 结晶的方法提纯乙;
(3)50℃时,配制一定量甲物质的饱和溶液,将溶液降温到10℃时,该溶液的溶质质量分数一定减小,该说法是 (填“正确”或“错误”).
(4)20℃时,向盛有20g乙物质的烧杯中加入50g水,充分溶解后形成的是 (填“饱和”或“不饱和”)溶液;
再将烧杯内的物质升温到50℃,此时溶液中溶质与溶剂的质量之比为 .

(1) ℃时,甲、乙两种物质的溶解度相等.
(2)溶解度随温度升高而降低的物质是 (填“甲”或“乙”).
(3)可使甲物质从其饱和溶液中结晶析出的方法是 .
(4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数 (填“大于”、“等于”或“小于”)乙溶液的溶质质量分数.

(1)点P表示 .
(2)当温度为t2℃时,A、B、C三种物质的溶解度由小到大的顺序是 .
(3)要使接近饱和的C物质溶液变为饱和的溶液,可采取的一种措施是 .
(4)t2℃时,A物质的饱和溶液150g降温到t1℃析出A物质 g(不含结晶水).
(5)将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,所得溶液中溶质的质量分数由大到小的顺序是 .
(6)当A中含有少量B时,为了得到纯净的A,可采用方法.

A.对除杂的认识 | B.用“化学”眼光分析 |
①用点燃的方法除去CO2中的CO ②用溶解、过滤、蒸发除去氯化钠中的泥沙 ③用冷却热的饱和溶液的方法除去硝酸钾中少量的氯化钠 | ①洗涤剂去油污是因为起乳化作用 ②明矾净水是因为明矾溶于水生成胶状物对杂质具有吸附能力 ③湿衣服晾干是因为分子间有间隔 |
C.对化学史的认识 | D.对概念的理解 |
①拉瓦锡最早通过实验得出空气的组成 ②门捷列夫发现了元素周期律编制了元素周期表 ③我国科学家张青莲对相对原子质量的 测定作出了卓越的贡献 | ①生成单质和化合物的反应一定是置换反应 ②能燃烧生成二氧化碳的物质中一定含有碳元素 ③合金比组成它的纯金属强度和硬度更高、抗腐蚀性能更好 |
(1)图中两种物质的溶解度曲线有一个交点A,点A 的含义是 .
(2)在60℃时,往盛有60g硝酸钾的烧杯中加入50g水,充分搅拌,所得溶液质量为 .
(3)在60℃,将等质量的两种物质的溶液分别降温到0℃,析出固体质量较少的是 .
A.氯化钠 B.硝酸钾 C.一样大 D.无法确定
(4)除去氯化钠固体中少量硝酸钾的方法是 (填写“蒸发结晶”或“降温结晶”).



-
(1) P点的含义是.
-
(2) t1℃时30g的a物质加入到50g水中不断搅拌,形成溶液的质量是g.
-
(3) a、b、c三种物质饱和溶液的温度分别由t2℃降到t1℃时,溶液中溶质的质量分数由大到小的顺序是.
-
(4) a中含有少量的b,若提纯a,可采用法.
-
(1) 我国著名化工专家侯德榜先生发明了“侯氏制碱法”为我国民族工业的发展做出了杰出贡献,“NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl“是侯氏制碱法的重要反应之一,下列有关说法错误的是 (填序号).A . 向饱和食盐水中先通入氨气,使溶液呈碱性,更易吸收酸性的CO2气体 B . 反应后,NaHCO3首先结晶析出,过滤即可将其分离出来 C . NaHCO3结晶析出后,剩余溶液中的溶质只有NH4Cl D . NaHCO3结晶析出后,剩余溶液还能继续溶解NaCl固体
-
(2) 海洋是巨大的资源宝库,我们可利用海水为原料制取大量的重要化工产品,例如:海水中存在大量的氯化钠,电解纯净的氯化钠溶液可以制得氢气、氯气和物质A,其反应原理为2NaCl+2H2O
 2A+Cl2↑+H2↑,试推断A的化学式为.
2A+Cl2↑+H2↑,试推断A的化学式为.
-
(3) t1℃时,将a、b两种固体各18g分别加入到盛有100g水的烧杯中,充分搅拌后实验现象如甲图所示,升温到t2℃时,实验现象如乙图所示,a、b两种固体在水中的溶解度曲线如丙图所示.

请根据如图实验现象及溶解度曲线填空:
①从t1℃到t2℃的变化过程中,一直处于饱和状态的是(填“a”或“b”)溶液.
②丙图中,曲线M表示的是(填“a”或“b”)的溶解度曲线.
③若a中混有少量b,可采用的方法提纯a.(填“蒸发结晶”或“降温结晶”).

-
(1) P点表示在t1℃两物质的溶解度关系为bc(填“>”、“<”或“=”).
-
(2) t2℃时,50g的 b物质加入到50g水中充分溶解后,所得溶液的质量为g.
-
(3) a中含有少量的b,若要提纯a,可采用结晶的方法.

-
(1) 反应②的化学方程式为,溶液b中的溶质有。
-
(2) 反应③的基本反应类型为。
-
(3) 操作Ⅱ的名称为。
-
(4) 从理论上讲,该实验过程最终得到的BaSO4质量与原方案得到的BaSO4质量是否相等?(填“是”或“否”)。

① a点表示的意义是20℃时,在中最多溶解硝酸钾31.6克。
② 60℃时,50克水中加入克硝酸钾恰好形成饱和溶液,再往该溶液中加入115克水后,硝酸钾溶液的溶质质量分数是。
③ 提纯混合溶液中的硝酸钾,进行如下实验。

操作III为下图中的(填序号),溶液M中所含溶质为。

④ 20℃时,将等质量的NaCl、KNO3固体分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到60℃时现象如图2(不考虑水分蒸发)。根据NaCl、KNO3物质的溶解度曲线回答:

甲烧杯中的加入固体是(填“KNO3”或“NaCl”)。
对乙烧杯中溶液的分析,正确的是(选填编号)
Ⅰ.从20℃升温到60℃过程中,溶质质量没有改变
Ⅱ.20℃时,其中溶质与溶剂的质量比为31.6:100
Ⅲ.将溶液从20℃降温,一定会析出晶体
Ⅳ.60℃时,乙烧杯中溶液一定是不饱和溶液
 、
、 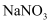 、
、  三种物质的溶解曲线如下图所示,下列说法正确的是()
三种物质的溶解曲线如下图所示,下列说法正确的是() 
 的溶解度比
的溶解度比  大
B . 将
大
B . 将  饱和溶液降温,溶液中
饱和溶液降温,溶液中  的质量分数不变
C .
的质量分数不变
C .  饱和溶液中含少量
饱和溶液中含少量  ,可通过降温结晶的方法提纯
D . 将100g40℃的
,可通过降温结晶的方法提纯
D . 将100g40℃的 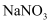 饱和溶液降温至0℃,析出31g晶体
饱和溶液降温至0℃,析出31g晶体



①图中a点的含义是;
②硝酸钾溶液中含有少量氯化钠,提纯硝酸钾的方法是、过滤、洗涤、干燥。
③ 10℃时向A中的硝酸钾溶液加入10g水并充分溶解,得到B溶液(如图所示),正确的说法是。

A 所得B溶液一定饱和 B 溶质质量一定变大
C 溶质质量分数可能变大 D若X=1.8g,所得溶液不饱和
④工业上用电解饱和食盐水的方法制取氢氧化钠。反应原理是2NaCl+2H2O  H2↑+X↑+2NaOH。实验中产生的X气体是(填化学式)。向电解后的溶液中滴加硫酸铜溶液,可观察到,证明反应生成了氢氧化钠。
H2↑+X↑+2NaOH。实验中产生的X气体是(填化学式)。向电解后的溶液中滴加硫酸铜溶液,可观察到,证明反应生成了氢氧化钠。

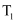 ℃时, A的饱和溶液中溶质质量分数为
℃时, A的饱和溶液中溶质质量分数为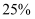 B .
B .  ℃时,A,B,C三种物质的溶解度大小关系为
℃时,A,B,C三种物质的溶解度大小关系为 C . 将
C . 将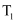 ℃时A,C的饱和溶液升温到
℃时A,C的饱和溶液升温到 ℃,A,C两种溶液都会变成不饱和溶液
D . A中含有少量B,要提纯A通常可采用冷却热饱和溶液的方法
℃,A,C两种溶液都会变成不饱和溶液
D . A中含有少量B,要提纯A通常可采用冷却热饱和溶液的方法

-
(1) t1℃时,A B C三种物质的溶解度由大到小的顺序是。
-
(2) 当温度在t1~t3℃之间时,A物质与B物质(填“能”或“不能”)配制溶质质量分数相同的饱和溶液。
-
(3) 将A,B,C三种物质的饱和溶液分别由t1℃升温到t3℃,所得溶液中溶质的质量分数最小的物质是。
-
(4) t3℃时,将150g A的饱和溶液稀释成10%的溶液需加g水。
| 选项 | 实验目的 | 实验方案 |
| A | 从含有少量氯化钠的饱和硝酸钾溶液中提纯硝酸钾 | 蒸发溶剂 |
| B | 鉴别Fe、CuO、C三种黑色固体粉末 | 滴加稀硫酸 |
| C | 检验碳酸钠溶液中是否含有氯化钠 | 先加过量的稀盐酸后,再滴加硝酸银溶液 |
| D | 除去二氧化碳中混有的少量氯化氢杂质 | 将混合气体先后通过饱和的氢氧化钠溶液和浓硫酸 |



