结晶的原理、方法及其应用 知识点题库
甲、乙、丙三种物质在不同温度下的溶解度见下表,下列有关说法正确的是( )

下图是甲、乙两种固体物质的溶解度曲线。下列有关叙述正确的是()
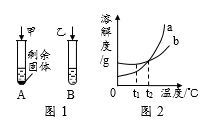
向装有等量水的A、B、C烧杯中分别加入5g、6g、6g某固体X,充分溶解后,现象如图一所示。
(1)烧杯中的溶液一定属于饱和溶液的是(填序号)。
(2)图二能表示固体X溶解度曲线的是(填“甲”、“乙”或“丙”)。
(3)甲溶液中混有少量丙,采用方法可以得到比较纯的甲。
(4)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的(填序号)。
①所含溶剂质量:甲<乙 ②甲、乙都是饱和溶液
③溶液质量:甲>乙 ④溶质质量分数:甲>乙.
A、B、C三种物质的溶解度曲线如图所示.
(1)P点表示t2℃时完全溶解30gA物质至少需 g水.
(2)t2℃时等质量的A、B、C三种饱和溶液中所含溶剂质量最多的是 (填写物质序号,下同).
(3)现有A、B、C三种物质的浓溶液,适用于海水晒盐原理进行结晶的是 .
(4)将t1℃时A、B、C三种物质的饱和溶液分别升温至t2℃时,所得溶液的溶质质量分数由大到小的顺序是 .


-
(1) 图1中,一定是饱和溶液是.
-
(2) 图2中,两溶液中溶质的质量分数甲乙(填“>”、“<”、“=”).
-
(3) 图3中,表示甲的溶解度曲线的是(填字母编号)
-
(4) 若使图2中乙溶液析出较多晶体应采取的结晶方法是.
如图是A,B,C三种物质的溶解度曲线,下列说法错误的是( )

-
(1) 如表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃)
0
10
20
30
40
50
60
70
80
90
100
KNO3
13.3
20.9
32
45.8
64
85.5
110
138
169
202
246
NaCl
35.7
35.8
36
36.3
36.6
37
37.3
37.8
38.4
39
39.8
Ⅰ.20℃时,NaCl的溶解度是 g.
Ⅱ.30℃时,KNO3溶液的最大浓度(溶质质量分数)为(只列计算式,不需要计算结果).
Ⅲ.KNO3 中含少量氯化钠时,提纯硝酸钾的一般方法是.
Ⅳ.根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是.
-
(2) 如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答.

Ⅰ.蒸发前原溶液是(填“饱和”或“不饱和”)溶液.n的数值是.
Ⅱ.依据上述实验,你认为甲的溶解度随温度变化的趋势是(填字母).
A.随温度升高而增大 B.随温度升高而减小 C.无法判断.


-
(1) t1℃时,A,B、C三种物质的溶解度由大到小的顺序是.
-
(2) 图中A、B两溶解度曲线相交于O点,此点表示的意义是.
-
(3) t1℃时,将A、B、C三种物质的饱和溶液分别升温到t3℃,所得的三种溶液中溶质的质量分数分别是a、b、c,则a、b、c的大小关系是.
-
(4) 当A中混有少量B时,可用(填“降温结晶”或“蒸发结晶”)方法提纯A.
-
(5) t2℃时,在90g10%的乙溶液中加入15g乙固体,充分搅拌,所得溶液的溶质质量分数为(计算结果精确到0.1%).

-
(1) t1℃时,A物质的溶解度为 g.
-
(2) a点的含义是;
-
(3) A物质中混有少量B物质,为获得大量A物质,一般采用的方法.

①下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水).
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl | 35.5 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
-
(1) 上表中的两种物质在40℃时,的溶解度较大;
-
(2) 请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法.
-
(3) 20℃时,将20g NaCl放入50g水中,所得溶液的质量是g.
-
(4) 从NaCl溶液中得到NaCl晶体的方法是.
-
(5) 60℃时,NaCl饱和溶液比KNO3的不饱和溶液浓(填“一定”“不一定”)
温度(℃) | 10 | 30 | 50 | 60 | |
溶解度 (g/100gH2O) | 氯化铵 | 33.3 | 41.4 | 50.4 | 55.0 |
硝酸钾 | 20.9 | 45.8 | 85.5 | 110.0 | |
(Ⅰ)从表可知,50℃时,50克水中最多可以溶解氯化铵克。

(Ⅱ)烧杯A是60℃时,含有100g水的氯化铵不饱和溶液,经过如下图的变化过程(在整个过程中,不考虑水分的蒸发),则到C烧杯溶液的质量为_g。

(Ⅲ)硝酸钾的溶解度曲线是(填“A”或“B”);50℃时,50g 水中加入45g 硝酸钾,充分溶解后,所得溶液的溶质质量分数为(精确到0.01);若要在含有少量氯化铵的硝酸钾溶液中,提取硝酸钾,可采用的方法是。
(Ⅳ)如图所示实验,除了验证氯化铵溶于水外,还有探究的目的,实验探究结论是。


-
(1) t1℃时,试管中的溶液一定是饱和溶液。
-
(2) 图2中表示乙物质溶解度曲线的是。
-
(3) 若甲物质中混有少量的乙物质,提纯甲物质可以采取的方法是 。
-
(4) 关于两支试管中的物质,下列说法错误的是______。A . t1℃时,试管A上层清液溶质质量分数<试管B中溶质质量分数 B . 保持温度不变,向试管A中加入一定质量的水,则溶液中溶质质量分数一定变大 C . 若温度升高到t2℃,两支试管中溶质质量分数一定相等(不考虑水分蒸发) D . 蒸发一定质量的水,两支试管中都一定有固体析出

已知:①在pH为4~5时,Fe3+几乎完全水解而转化为Fe(OH)3沉淀,Cu2+却不水解。
②含Fe3+溶液遇到硫氰化钾(KSCN)溶液能够很灵敏显现出红色。
-
(1) 在“酸浸”步骤中为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是,酸溶过程中发生反应的化学方程式:。(写一个)
-
(2) 氧化剂A是为了将Fe2+转变为Fe3+ , 以便在后续操作中将溶液中的铁元素除去。从产品的纯度考虑,可选用下列氧化剂中的(填编号)。
A KMnO4 B HNO3 C Cl2 D H2O2
-
(3) 在实验室进行“操作1”所需的玻璃仪器有烧杯、玻璃棒和,在此过程中造成滤液浑浊可能的原因。
-
(4) 设计最简实验证明滤液中Fe3+已沉淀完全(写出操作、现象及结论,试剂任选)。
-
(5) 用试剂B调节溶液 pH至5,从产品的纯度考虑,试剂B最好选用(填编号)
A NaOH B CuO C Fe2O3 D Fe
-
(6) 从滤液经过结晶得到氯化铜晶体的方法是:、冷却结晶、过滤、洗涤、低温烘干。


-
(1) t1℃时,将25g固体C加到50g水中,充分搅拌后所得溶液的质量为g。
-
(2) 分别将t2℃时的A,B,C的饱和溶液降温到t1℃,所得溶液溶质质量分数由小到大的顺序是。
-
(3) 某小组欲从含有少量B的A样品中提纯A固体,可采用的提纯方法是(填“降温结晶”或“蒸发结晶”)。
-
(4) 一定温度下,向图2的烧杯中加入一定量的水后如图3所示,所得溶液与原溶液相比,下列判断一定 正确的是(填序号)。
A 所得溶液是饱和溶液
B 溶质质量分数变大
C 溶质的质量增加
D 溶质的溶解度变大
-
(1) 氯化钠、硝酸钾、氢氧化钙在不同温度时的溶解度如下表所示:
温度/℃
0
20
40
60
80
100
溶解度/g
氯化钠
35.7
36.0
36.6
37.3
38.4
39.8
硝酸钾
13.3
31.6
63.9
110
169
246
氢氧化钙
0.19
0.17
0.14
0.12
0.09
0.08
①60℃时,氯化钠的溶解度硝酸钾的溶解度(填“>”“<”或“=”)。
②氢氧化钙的饱和溶液加热后变浑浊,原因是。
③20℃时,向氢氧化钙的饱和溶液中加入少量生石灰并恢复至20℃,溶液中溶质的质量(填“增大”“减小”或“不变”)。
④要从含有少量氯化钠的硝酸钾溶液中得到较多的硝酸钾,可以采用加热浓缩、过滤的方法,得到的滤液中含有的离子有(填离子符号)。
-
(2) 实验兴趣小组需要使用溶质质量分数为10%的氢氧化钠溶液。用氢氧化钠固体配制50g溶质质量分数为10%的氢氧化钠溶液,配制过程如下图所示:

①指出图中称量步骤的不正确操作:;。
②若用质量分数为25%的氢氧化钠溶液配制50g质量分数为10%的氢氧化钠溶液,所需25%的氢氧化钠溶液和水的质量比为。



