结晶的原理、方法及其应用 知识点题库
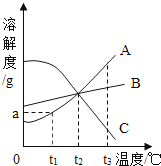
如图是A、B、C三种物质的溶解度随温度变化的曲线图.根据图回答:
-
(1) S表示物质的溶解度,当温度为℃时SA=SB;
-
(2) 随着温度升高,A,B,C三种物质的饱和溶液中能析出溶质的是.
-
(3) B中混有少量的A,欲提纯B,应采用的方法是(填“降温结晶”或“蒸发结晶”).
-
(4) t3℃时,90gA物质的饱和溶液中,含有A物质g.
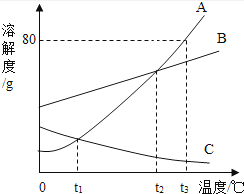
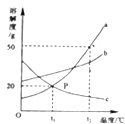
甲、乙、丙三种固体物质在水中的溶解度曲线如图所示.请回答:
(1)图中P点的意义是 ;
(2)若甲中混有少量的乙,最好采用 的方法提纯甲;
(3)使30℃接近饱和的甲溶液变成该温度下的饱和溶液,可采用的一种方法是 ;
(4)使50℃甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的是 ;
(5)向100g 50℃的水中加入65g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出.你认为“全部溶解”的原因可能是 .
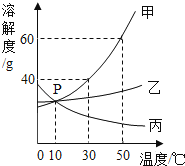
(1)烧杯中的溶液一定属于饱和溶液的是 (填序号);由图可知,形成饱和溶液的影响因素是 ;
(2)图二能表示NaNO3溶解度曲线的是 (填“甲”或“乙”);
(3)欲除去混在甲中的少量乙物质可采用的方法是 ;
(4)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的 (填序号).
A.甲、乙都是饱和溶液B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙D.溶质质量分数:甲>乙.
三种固体物质a、b、c的溶解度曲线如图所示,则下列说法不正确的是( )
-
(1) 空气中含量最多的气体是,它约占空气总体积的.
-
(2) 使用硬水会给生活和生产带来许多麻烦.区别硬水和软水的常用试剂是,生活中常用的方法降低水的硬度.
-
(3) 从海水中提取粗盐常用(填“冷却热的饱和溶液”或“蒸发溶剂”)的方法.
-
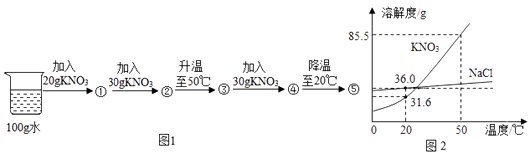
(1) 20℃时,KNO3的溶解度(S)=;⑤是(填“饱和”或“不饱和”)溶液.
-
(2) 50℃时,饱和NaCl溶液中溶质的质量分数(w1)与饱和KNO3溶液中溶质的质量分数(w2)的大小关系是:w1(填“>”“=”或“<”)w2 .
-
(3) 小明发现:升温至50℃,②→③的过程中有少量水蒸发,下列叙述正确的是(填序号)
a.①、②均为不饱和溶液
b.②→③的过程中溶质质量分数变大
c.④→⑤的过程中析出KNO3晶体53.9g
-
(4) 除去KNO3固体中混有的少量NaCl的实验操作为:加适量水溶解→加热得到热饱和溶液→→过滤→洗涤→干燥→KNO3 .
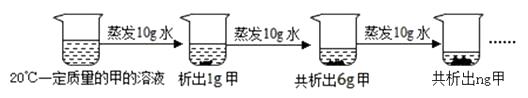
-
(1) 蒸发前原溶液是(填“饱和”或“不饱和”)溶液,n的数值是;
-
(2) 依据上述实验,你认为甲的溶解度随温度变化的趋势是 (填字母)的。A . 随温度升高而增大 B . 随温度升高而减小 C . 无法判断
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
据此数据,判断下列说法不正确的是( )
-
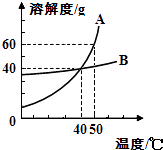
(1) 50℃时,35g A物质加到50g水中充分溶解后,所得溶液的质量为g;
-
(2) 40℃时,将A,B两种恰好饱和的溶液升温到50℃时,所得溶液溶质质量分数的大小关系是:AB(填“大于”、“小于”或“等于”);
-
(3) 我国有许多盐碱湖,湖中溶有大量的NaCl和Na2CO3 , 那里的人们“冬天捞碱,夏天晒盐”,据此你认为图中(填“A”或“B”)物质的溶解度曲线与纯碱的相似.
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | 碳酸钠 | 7.0 | 12.5 | 21.5 | 39.7 | 49.0 |
氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | |
-
(1) 20℃时,30g碳酸钠和30g氯化钠的固体混合物加入到100g水中,充分搅拌后(填“是”或“否”)有固体剩余。
-
(2) 生活在盐湖附近的人们“夏天晒盐(氯化钠)”、“冬天捞碱(碳酸钠)”,其冬天捞碱依据的原理是 (填“蒸发结晶”或“降温结晶”)。
-
(3) 将300g碳酸钠溶液和150g石灰水溶液混合后,恰好完全反应,过滤,得到白色沉淀50g,则所得的滤液中溶质的质量分数多少?。

-
(1) 试剂X可用(选填序号)。
a . NaOH溶液
b.Na2CO3溶液
c.K2CO3溶液
-
(2) 操作I需要用到的玻璃仪器有、和烧杯。
-
(3) 操作II的名称为。
-
(1) 化学是一门以实验为基础的学科,根据图中实验回答下列问题。
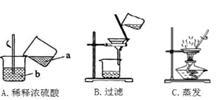
实验A中的a应为(填“浓硫酸”或“水”)。实验操作A、B、C都需要用到玻璃棒,其中操作A中玻璃棒的作用是。
-
(2) 在实验室闻浓盐酸和浓硫酸的气味时应该小心,,使较少量的气体飘进鼻孔,发现有刺激性气味的。

| 温度/℃ | 20 | 30 | 40 | 60 | |
| 溶解度/g | KCl | 34.0 | 37.0 | 40 | 42.6 |
| NaNO3 | 88.2 | 96.5 | 102.1 | 125.5 | |
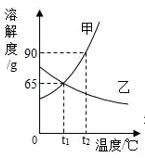
-
(1) ℃时,甲、乙两种物质的溶解度相等。
-
(2) 溶解度随温度升高而降低的物质是(填“甲”或者“乙”)。
-
(3) 可使甲物质从其饱和溶液中结晶析出的方法是。
-
(4) t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数(填“大于”“等于”或“小于”)乙溶液的溶质质量分数。
-
(5) 小明同学用甲物质进行如图实验:
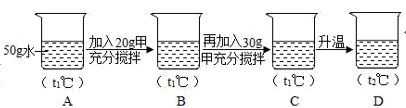
①实验过程中,B、C、D对应的溶液为不饱和溶液的是。
②向B对应的溶液中再加入30g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因是。
③两种物质溶解度关系为乙>甲时的温度为t,由图可知t的取值范围是。
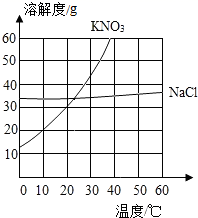
-
(1) 在10℃时,KNO3的溶解度约为g(取整数)。
-
(2) 10℃时,20gKNO3在50g水中充分溶解,所得溶液的质量分数为。
-
(3) 若KNO3中混有少量的NaCl,可采用(填“降温结晶”或“蒸发结晶”)的方法提纯KNO3。



