实验探究物质的性质或变化规律 知识点题库
在研究氧气的性质时,同学们发现含氧元素的质量可以相互转化,如“氧化物甲 氧气
氧气 氧化物甲”的转化,反应I的化学方程式为 。
氧化物甲”的转化,反应I的化学方程式为 。
【提出问题】铁丝能在氧气中燃烧,观察到火星四射、剧烈燃烧 。能不能将燃烧产物四氧化三铁再转化为铁单质呢?
【查阅资料】(1)Fe3O4的分解温度为1538℃
(2)CO具有还原性,能将某些金属氧化物还原为金属单质
(3)酒精灯外焰温度约700 ℃,酒精喷灯火焰温度约1000℃
(4)铁丝为银白色,铁粉为黑色
【设计实验】同学们设计了如下图所示的实验装置,对CO能不能将四氧化三铁转化为铁进行探究。结合图示回答问题。

(1)B装置中浓硫酸具有吸水性,能除去二氧化碳中的水蒸气,浓硫酸吸水过程会 (填“吸热”或“放热”)。
(2)C装置可将二氧化碳转化为一氧化碳,反应的化学方程式为 。
(3)F处点燃酒精的目的是。
(4)依据现象得出结论,该设计中观察到以下现象,其中可以说明四氧化三铁与一氧化碳发生反应的现象是(填字母序号)。
| A.澄清石灰水变浑浊 | B.反应前后D中质量减轻 |
| C.F导管口有蓝色火焰 | D.加热时,四氧化三铁变红 |
【反思与评价】由于上述实验设计有明显不足,致使某些现象不能作为推理的依据,其中的不足是 。
-
(1) 实验室常用无水醋酸钠(CH3COONa)固体和碱石灰混合加热的方法制取甲烷。

图A中标有序号的仪器名称:①,②。实验室制取甲烷应选择的发生装置是(填标号)。用C装置收集甲烷,发生装置的导管口应与(填“a”或“b”)端相连。甲烷完全燃烧的化学方程式是。
-
(2) 小林同学发现铜制眼镜框表面出现了绿色物质,通过化学学习知道该物质为铜锈,俗称铜绿,主要成为是Cu2(OH)2CO3。
[提出问题] 铜在什么条件下锈蚀的?
小林对此进行了研究。
[猜想] 根据铜锈的化学式,猜想铜生锈可能是铜与O2、、共同作用的结果。
-
(3) [设计与实验] 借鉴“铁钉锈蚀条件的探究”实验,小林设计了“铜片锈蚀条件的探究”实验如下图所示。实验较长时间后,发现B试管中的光亮铜片最先生锈。
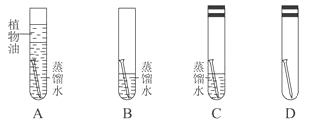
① 从优化实验的角度考虑,A实验是多余的,他只考虑了水这个单一条件。C试管中除光亮铜片、蒸馏水外,还有的另外一种物质为。D试管中除光亮铜片外,还有的另外两种物质为;从D试管的实验中,获得的结论是。
② [评价与改进] 小林设计的“铜片锈蚀条件的探究”实验不够完善,要得出正确结论,还要补充的一个实验是。
[反思与小结] 通过铜片锈蚀条件的探究实验,我获得的启示是。
【猜想与假设】猜想1:灯芯与焰心交界处温度低于火柴头的着火点。猜想2:灯芯与焰心交界处氧气浓度太低,不支持火柴头的燃烧。猜想3:两者均是影响因素。
【查阅资料】①火柴头主要由KClO3、MnO2、易燃物及粘合剂等组成,用红外线测温仪测得火柴头的着火点约是303.4℃。②火柴头在氧气浓度为12.2%的气体中不能燃烧。

【实验验证1】为了验证猜想1,小明利用高温传感器测定酒精灯灯芯和焰心交界处的温度(如图),得到的数据如下:
测量次数 | 第1次 | 第2次 | 第3次 |
温度/℃ | 236 | 243 | 240 |
-
(1) 小明进行多次测量的目的是。
-
(2) 仅由上表可知,灯芯上火柴头未烧着的原因是。
-
(3) 请写出火柴头擦燃过程中发生反应的化学方程式(根据资料提供物质),联想到火柴燃烧时出现的白烟,小明推测白烟的成分可能是。
-
(4) 【实验验证2】为了验证猜想2,小红用注射器抽取酒精灯灯芯和焰心交界处的气体,并利用氧气传感器测量氧气的体积分数,数据如表。
测量次数
第1次
第2次
第3次
平均值
氧气的浓度/%
5.93
5.29
6.53
5.92
根据实验1、2探究内容,可知猜想符合题意。
-
(5) 小红测出的几组氧气浓度存在差异的原因可能是。
-
(6) 【反思评价】如图是小组同学将火柴头置于装有空气的密闭的容器中燃烧,并用氧气传感器在容器项端测量整个过程容器内氧气浓度变化,那么在(填“A、B、C、D”)点时火柴头熄灭;

请你根据所学推理并解释曲线A8段、BC段、CD段氧气浓度变化的原因。①;②;③。
-
(1) 小明首先根据草酸中含有元素,可推测生成物中一定含有水。
-
(2) 小明对分解生成的其他产物进行猜测、验证:
【假设一】 生成物中有二氧化碳
实验一:将生成的气体通入澄清的石灰水,实验现象是,小明据此判断生成物中含有二氧化碳。
-
(3) 【假设二】 生成物中有一氧化碳
实验二:小明用下图装置进行实验,从而证明生成物中含有一氧化碳。

请回答:A装置中黑色固体粉末是 (填化学式),A装置中的实验现象是。
-
(4) 讨论交流:
小芳认为,小明的“实验二”不需要B装置也能够推断出生成物中含有一氧化碳,你是否支持小芳的观点:(填“支持”或“不支持”),请说出你的理由:。小芳认为,从环保的角度看,“实验二”装置有一个缺陷,请你指出该缺陷:。
【实验设计】按图设计组装好仪器,检查气密性,装入药品。

-
(1) 【进行实验】
①A中氧化铜全部转化成光亮的红色固体。
②B中U形管内物质变蓝。
③C中集气瓶内收集到一种无色气态单质,该气体用排水法收集的理由是。
④从C中水槽里取适量液体于试管内,向试管里滴入无色酚酞溶液,溶液呈色,原因是。
-
(2) 【实验结论】氧化铜和氨气发生反应,化学方程式是。
-
(3) 【继续探究】
①测得有关数据如下表:
质量
实验前
实验后
氧化铜粉末+玻璃管
65.6g
59.2g
在此反应中,参加反应的氧化铜的质量为g。
②A中玻璃管内的反应证明,氨气的化学性质与(填物质化学式)有相似之处。
-
(1) (资料显示)
a.钾在常温下就能与水发生剧烈的反应,请补充完整发生反应的化学方程式:。
b.碱式铜盐为蓝绿色沉淀。
c.钾在空气中其表面很快会被氧化。
-
(2) (提出猜想)
猜想一:金属钾和硫酸铜溶液反应会有铜生成。
猜想二:金属钾和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
(实验及现象)切取不同大小的钾块分别投入两种不同浓度的硫酸铜溶液中,有关实验现象如表所示:
实验及现象
实验编号
钾块大小
硫酸铜溶液
实验现象
①
绿豆大小
稀溶液10 mL
产生蓝绿色沉淀
②
绿豆大小
浓溶液10 mL
产生蓝色絮状沉淀
③
黄豆大小
稀溶液10 mL
产生蓝色絮状沉淀
④
黄豆大小
浓溶液10mL
产体生蓝色絮状沉淀,并出现黑色固体
(实验结论)
a.上述实验中均未观察到色固体生成,由此判断猜想一错误。
b.实验①中观察到的沉淀是蓝绿色的由此判断猜想二(填“正确”或“错误”)。
-
(3) (实验反思)
①实验中生成氢氧化铜沉淀的原理是(用化学方程式表示)。
②由上述实验可知,导致钾和硫酸铜溶液反应产生的产物不同的因素有。
-
(4) (拓展提升)
为了用钾置换硫酸铜中的铜元素,老师设计了如下实验方案:
方案Ⅰ:把钾块和无水硫酸铜直接混合,在干燥的空气中加热。
方案Ⅱ:把钾块和无水硫酸铜直接混合,隔绝空气加热。
两个方案中你认为更合理的是方案,理由是。
I、初步试验—实验1

初步结论:淀粉液的种类、浓度和碘水的浓度可能会影响混合液的颜色
II、依据初步结论,深入探究
实验2

实验3

实验4……
(解释与结论)
-
(1) 能使淀粉液变“蓝墨水”的试剂是。
-
(2) 实验2的目的是。
-
(3) 结合实1可知,实验3-3中混合液的颜色是。
-
(4) 实验3的结论是。
-
(5) (反思与评价)
对比实验1-1和1-3不能得出结论“淀粉液的种类一定会影响混合液的颜色”的原因是。
-
(6) 对比实验2-1和3-1,发现混合液的颜色不同,推测其原因可能是。

-
(1) 对于反应4Fe(OH)2+O2+2H2O=4Fe(OH)3 , 它的化学反应基本类型是,其中化合价升高的元素为。(写元素名称)
-
(2) 配制药品的蒸馏水需要加热煮沸,解释原因。
-
(3) 实验得到氢氧化亚铁涉及到的化学方程式有:
①Fe+H2SO4═FeSO4+H2↑ ②。(写出化学方程式)
-
(4) 试管Ⅰ中加入的药品为,试管Ⅱ中加入的药品为。(均写名称)
-
(5) 请将缺少的实验步骤补全:如图连接好仪器→检查装置气密性→装入药品迅速塞紧塞子→打开止水夹→,很快观察到白色沉淀在试管中产生(填“Ⅰ”或“Ⅱ”)。

-
(1) 以上三个实验中,①②有明显现象,请你帮小楠记录他观察到的现象。实验①:;实验2:。
-
(2) 实验③中玻璃广口瓶未观察到明显现象,请你帮小楠寻找一种生活用品替代该装置中的广口瓶,以使实验取得成功。你选用的物品是,改进后看到实验的现象是。
-
(3) 写出CO2与NaOH溶液反应的化学方程式:。在各装置中的现象虽然不同,但其原理都是。
-
(4) 通过本次实验探究,可知:氢氧化钠应保存。

【实验1】如图1所示,向NaOH溶液中通入CO2一段时间,用pH传感器采集的数据绘制成的曲线如图2。
-
(1) 反应过程中,溶液的碱性逐渐(填“增强”或“减弱”)。此现象可说明反应物中的减少,从而证明CO2和NaOH发生了反应。
-
(2) [实验2]用图3所示的装置进行实验。
先把注射器中的NaOH溶液推进烧瓶中,一会后打开止水夹,观察到的现象是,产生这一现象的原因是。
小明认为该实验还不足以证明CO2与NaOH发生了反应,其理由是。
-
(3) 要检验二氧化碳与氢氧化钠溶液的反应,除了从反应物的角度外,还可从生成物的角度。实验如图4所示:所加试剂A为,观察到的现象是,右边试管发生反应的化学方程式为。
【提出问题】Cu 生锈产生的铜绿与什么物质有关呢?
【假设猜想】猜想1 需要H2O和O2;猜想2 需要H2O和CO2;猜想3 需要O2和CO2;猜想4需要H2O、CO2和O2
-
(1) 【讨论分析】小红认为猜想不成立,理由是; 小兰认为猜想不成立,理由是。
-
(2) 【实验验证】
实验操作
两周后的现象
结论
实验1

铜片表面
猜想4成立
实验2

铜片表面
-
(3) 【得出结论】铜在H2O、CO2和O2 同时存在的条件下才能产生铜绿,反应的化学方程式为:。
-
(4) 【拓展反思】铁在潮湿的空气易生铁、铜在潮湿的空气中也会生锈、但黄金、白银却能长期保存而不易被氧化,可见,金属被腐蚀的难易程度与有关。

-
(1) (实验一)
取①②两种固体少量,小心研细,分别放入A、B两个玻璃杯中,加入一定量的水并用筷子搅拌,观察到玻璃杯中均出现浑浊现象;用手触摸杯壁,B中发热,其原因是(用化学方程式表示);将固体研细及用筷子搅拌的目的是。
取少量A、B杯中上层清液混合,溶液无明显变化。
向A中加入适量白酒,搅拌静置,再将A、B杯中清液混合,溶液变红。由此说明:相同条件下,酚酞在酒精中的溶解度比水中(填“大”成“小”)。
(网上讨论)
甲同学认为:B中出现浑浊现象,证明该干燥剂已部分变质生成了碳酸钙。乙同学认为这种说法不正确,其理由是。
-
(2) (实验二)
将B中上层清液缓缓倒出后,再向玻璃杯中加入足量白醋,观察到现象,说明该干燥剂已经变质生成碳酸钙。产生该现象的化学方程式为。
-
(1) Ⅰ、挥发性
(实验1)取一瓶质量分数为68%的浓硝酸,打开瓶盖,遇潮湿的空气,瓶口可以看到,原因是。
-
(2) Ⅱ、不稳定性
(查阅资料1)硝酸是无色液体,见光或受热分解生成红棕色的NO2气体、氧气及一种无色液体
硝酸分解的化学方程式为:。
-
(3) (实验2)取3份浓度和体积均相同的浓硝酸分别放入3支试管中,塞好塞子,放置在室外阳光充足的地方(气温为26℃)。记录溶液上方的气体颜色随时间的变化情况。
实验编号
①
②
③
实验条件



实验现象
6分钟出现浅红棕色
15分钟红棕色比较明显
30分钟红棕色非常明显
60分钟无明显变化
3分钟出现浅红棕色
6分钟红棕色比较明显
10分钟红棕色非常明显
实验①、②对比是研究对浓硝酸稳定性的影响。
实验①、③对比可得出的结论是。
-
(4) Ⅲ、酸性
(查阅资料2)硝酸能够与金属氧化物反应生成盐和水。
(实验3)向氧化铜粉末中加入硝酸,能够看到的现象是。
IV、氧化性
(查阅资料3)浓硝酸在加热条件下能与木炭发生反应:
C+4HNO3(浓)
 4NO2↑+CO2↑+2H2O。
4NO2↑+CO2↑+2H2O。(实验4)如图所示,将红热的木炭伸到浓硝酸上方,观察到有红棕色气体产生。请解释生成该红棕色气体的原因可能是。

-
(1) 探究I:药品添加顺序是否对波尔多液药效有影响
(实验1)小组同学进行了如下实验:将试剂I加入到盛有试剂Ⅱ的烧杯中,配得1号波尔多液;操作X , 配得2号波尔多液。分别将1号、2号波尔多液喷洒在有霜霉病的葡萄上。几天后,观察到波尔多液的药效1号比2号更好,说明药品添加顺序不同对波尔多液的药效有影响。
操作X是。
-
(2) 通过分析,小组同学认为波尔多液不具备溶液的特征,故不属于溶液。溶液的特征是。
-
(3) 小组同学将配得的波尔多液过滤、干燥,得到蓝绿色滤渣。于是提出:滤渣中含有哪些元素?
探究Ⅱ:滤渣中含有哪些元素?
(查阅资料)碱式硫酸铜(Cu2(OH)2SO4)(是难溶于水的绿色固体;氢氧化铜和碱式硫酸铜均能受热分解。
(作出猜想)小组同学结合查阅的资料、原料成分和滤渣颜色,推测:滤渣中可能含铜、氧、氢、硫、钙元素中的一种或几种。
(实验2)用如图所示装置进行实验。实验开始先通入一会儿氮气,然后关闭弹簧夹,点燃酒精灯给滤渣加热。观察到:①滤渣变为黑色固体;②…;③石蕊溶液变红。

根据现象②“”,得出:滤渣中含有氢和氧两种元素;根据现象③3“石蕊溶液变红”得出:滤渣中含有硫和氧两种元素。
-
(4) 若实验开始时不通入氮气,则该实验无法判断滤渣中一定含有氧元素,理由是。
-
(5) (实验3)根据(实验2)中的现象①,推测该黑色固体可能是氧化铜,滤渣中还含有铜元素。于是小组同学继续利用图所示装置,将试管中的“紫色石蕊溶液”换成“澄清石灰水”,进行如下实验:
实验操作
实验现象
实验结论
操作Y , 点燃酒精灯
①………
②澄清石灰水变浑浊
黑色固体是氧化铜
操作Y为。
-
(6) 该实验中的现象①为。
-
(7) (实验4)小组同学经讨论后认为:还可用更简单的如图所示的方法,验证黑色固体是氧化铜。则试管中发生反应的化学方程式为。

(实验结论)经过上述实验,小组同学得出:滤渣中一定含铜、氧、氢、硫元素。
(提出问题)氧化铜能否作为过氧化氢分解的催化剂?
(进行实验)

①如图连接装置,加入20毫升10%过氧化氢溶液,收集氧气
②向锥形瓶中加入二氧化锰粉末,加入10%的过氧化氢,观察现象并记录相关数据如表
③清洗并干燥装置,换用氧化铜粉末重复步骤②,相关数据记录表中,据此分析:
| 步骤 | 物质 | 质量/g | 10%过氧化氢体积/mL | 集满一瓶氧气所用时间/s |
| ① | / | / | 20 | 630 |
| ② | 二氧化锰 | 0.5 | 20 | 25 |
| ③ | 氧化铜 | ……. | 20 | 38 |
-
(1) 步骤①中a所示仪器的名称是。
-
(2) 步骤③中所加氧化铜的质量是g。
-
(3) (得出结论)根据上述实验步骤和(填序号,下同)比较得出氧化铜可作为过氧化氢分解的催化剂;根据上述实验步骤和比较得出二氧化锰的催化效果更好。
-
(4) 写出步骤③反应的文字或符号表达式。
-
(5) 小徐同学分析了小明的实验过程后,认为还需要补做几个实验步骤,才能证明氧化铜在该反应中起催化作用。步骤继续设计如下:
④将反应结束后剩余氧化铜固体进行过滤、洗涤、干燥并(填写操作名称),证明氧化铜在反应前后质量未发生变化;
⑤将上一步所得固体加入少量等浓度的过氧化氢溶液,伸入带火星的木条,观察木条复燃,证明氧化铜的在反应前后未发生变化。



关于实验有如下的说法:
①图1、图2所示装置同时进行实验,几分钟后观察到棉纱布A比C先变红
②三个实验都可以证明分子在不断运动
③相比于教材上的分子运动实验,以上三个实验都更环保,更节约试剂
④图3实验现象可以证明,相比之下氨分子运动速率更快
⑤本实验可以证明分子运动速率既与温度有关,也与分子种类有关
⑥图1、2中发生的是物理变化,图3中发生的是化学变化
以上说法正确的个数是( )
(一)气体成分的探究
(资料1)①无水硫酸铜遇水变蓝;
②氢氧化钠溶液可以充分吸收CO2。
-
(1) (实验)将生成的气体通入到下图装置

(现象)实验中观察到A中,说明有水生成, B中澄清石灰水变浑浊,说明生成了, B中发生反应的化学方程式为。
-
(2) (数据)充分吸收生成的气体后测定,A装置增重0.18g, B和C装置共增重0.88g,
(计算) a:b:c=。
-
(3) (二)红色固体成分的探究
(资料2)1、Cu和Cu2O均为红色固体;2、Cu2O+ H2SO4=CuSO4+Cu+H2O。
(猜想)红色固体可能是:猜想1:Cu 猜想2:Cu2O 猜想3:
-
(4) (实验)①取适量红色固体,加入足量稀硫酸,观察到(填现象),则猜想1是错误的。
②反应后测得红色固体质量为2.16g
-
(5) (结论)结合以上数据,写出该碱式碳酸铜分解的化学方程式。

-
(1) 当把分液漏斗中的氢氧化钠溶液滴入装有CO2的密闭瓶中后,可观察到的现象是?有同学认为此现象还不能证明CO2与氢氧化钠发生了反应其,理由是?
-
(2) 通过实验证明CO2确实与氢氧化钠发生了反应,反应后溶液中的溶质可能只有碳酸钠,也可能还有氢氧化钠,请设计实验检验溶质的成分简要写出实验步骤、现象和结论。(提示:碳酸钠溶液呈碱性)


问题一:茶垢清洁剂溶于水时生成过氧化氢,是否有生成氧气?
实验Ⅰ:在盛有茶垢清洁剂固体的小烧杯中,加适量常温水,完全溶解后得到无色溶液,观察到有小气泡缓慢冒出,伸入带火星木条,木条不复燃。
实验Ⅱ:取三份等量的实验Ⅰ中的溶液,分别加入三支试管中,按图2所示进行实验。观察到都能较快产生气泡且温度越高产生气泡越快;伸入带火星的木条,木条都复燃。
[实验结论]通过实验证明,茶垢清洁剂溶于水时生成氧气。
-
(1) 实验Ⅰ中“木条不复燃”的原因是。
-
(2) 问题二:茶垢清洁剂溶于水时生成碳酸钠,是否生成氢氧化钠?
实验Ⅲ:取图2中丙试管内溶液,按下图流程进行实验

【交流表达】
①加入试剂X的目的是。
②溶液M呈色,说明茶垢清洁剂溶于水时没有生成氢氧化钠。
-
(3) 【反思总结】
①茶垢清洁剂溶于水生成了碳酸钠和过氧化氢。碳酸钠溶液有较好的去污效果;过氧化氢分解生成活性氧,可深层带走污垢。
②使用茶垢清洁剂时应选择硬度较小的水进行溶解,去垢效果更好。请解释原因。
84消毒液是一种以次氯酸钠(NaClO)为主要成分的高效消毒剂,广泛应用于杀灭细菌、病毒并抑制其传播,起到预防疾病的作用。1984年,北京第一传染病医院(地坛医院的前身)研制成功能迅速杀灭各类肝炎病毒的消毒液,定名为“84”肝炎洗消液,后更名为“84消毒液”。由于其消毒效果理想、价格低廉、使用方便,且具有广谱、高效的杀菌特点,深受大家的欢迎。84消毒液通常为无色或淡黄色液体,pH在12左右,有刺激性气味,有效氯含量为1.0%至6.5%不等。由于其有一定的刺激性和腐蚀性,浓度过高会损害呼吸道,危害身体健康,所以必须稀释后才能使用。一般认为,当杀菌率达到90%以上时,说明此时的消毒具有较好效果。表1、图1为某学校喷洒不同浓度的84消毒液,对教室进行消毒后的效果比较。
表1 不同浓度的84消毒液对教室的消毒效果
班级 | 一班 | 二班 | 三班 | 四班 | 五班 | 六班 | 七班 | 八班 | |
喷洒消毒液的浓度(消毒液与水的体积比) | 1:50 | 1:100 | 1:150 | 1:200 | 1:300 | 1:600 | 1:1000 | 作为对照不喷洒消毒液 | |
菌落数 | ① | 2 | 2 | 4 | 6 | 10 | 19 | 45 | 53 |
② | 3 | 3 | 5 | 4 | 11 | 18 | 42 | 50 | |
③ | 1 | 3 | 4 | 5 | 12 | 19 | 43 | 48 | |
平均值 | 2 | 2.67 | 4.33 | 5 | 11 | 18.67 | 43.33 | 50.33 | |

84消毒液除了具有腐蚀性,其使用过程中放出的氯气是一种有毒气体,有可能引起中毒。氯气主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,造成呼吸困难。症状重时,会发生肺水肿而致死亡。室内使用84消毒液后,可开窗通风一段时间。由于在酸性较高的条件下更易生成氯气,所以禁止将84消毒液与酸性物质混用,也不建议把84消毒液与洗涤剂或其他消毒液混合使用。84消毒液在日常生活中发挥着重要作用,我们要了解它的成分和原理,才能合理安全地使用。依据文章内容回答下列问题。
-
(1) 84消毒液呈(填“酸性”、“碱性”或“中性”)。
-
(2) 84消毒液的物理性质为(写一条即可)。
-
(3) 结合表1和图1数据,关于不同浓度的84消毒液与其消毒效果可得到的结论为。
-
(4) 若想达到较好的消毒效果,同时又减少其对身体和环境的影响,学校喷洒消毒液浓度的最适合范围为(填字母序号,下同)。
a.1:50~1:100 b.1:100~1:200 c.1:200~1:600 d.1:600~1:1000
-
(5) 下列说法错误的是____。A . 浓度为1:1000的84消毒液不具有消毒效果 B . 84消毒液可与洁厕灵(主要成分为HCl)混用 C . 84消毒液名称由来是因为其中有效氯含量为84% D . 教室使用84消毒液消毒后,建议开窗通风一段时间



