实验数据处理或者误差分析的探究 知识点题库
| 反应前 | 反应后 | ||
| 实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 160 g | 12 g | 167.6 g | |
-
(1) 根据质量守恒定律可知,反应中生成二氧化碳的质量为g
-
(2) 求该石灰石中碳酸钙的质量分数。
有一种工业废水,其中含有大量的硫酸镁,少量的银离子以及污泥.某同学设计了一个既经济又合
理的方法回收银和硫酸镁晶体.方案流程如下:

回答下列问题:
-
(1) 步骤②中:需加入的物质是
-
(2) 步骤③中:需加入的物质是 ,当观察到 时,则停止加入该物质,发生反应的化学方程式是 .
-
(3) 某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理? ,理由是 .
-
(4) 步骤④的操作是 ,溶液2和溶液3为什么要混合? .
 Na2CO3 + CO2↑+ H2O,杂质不参加反应。碱石灰是NaOH和CaO的固体混合物。)
Na2CO3 + CO2↑+ H2O,杂质不参加反应。碱石灰是NaOH和CaO的固体混合物。)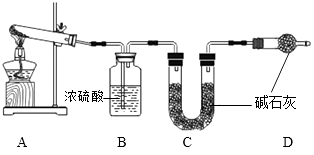
回答下列问题:
-
(1) 小苏打在生活中的一种用途是。
-
(2) 10.0g样品充分加热后生成CO2g。
-
(3) 根据提供的数据,计算样品中NaHCO3的质量分数。(写出详细的计算过程)
-
(4) D装置的作用是;某同学通过测定B装置反应前、后的质量计算出样品中NaHCO3的质量分数比实际值偏大,可能的原因是。
-
(1) 计算:需要溶质质量分数为98%的浓硫酸的质量为 g;
-
(2) 量取:量取所需的水时俯视读数,其他操作均正确,则配制出的稀溶液的质量分数19.6%(选填“>”、“=”或“<”);
-
(3) 混匀:①先将倒入烧杯中,再加入另一种液体,否则可能造成酸液四溅;
②混匀过程中要用搅拌,使产生的热量及时逸散;
③装瓶贴标签:使用后盖好瓶塞保存。
【查阅资料】“暖宝宝”中含有铁粉、活性炭、水、氯化钠等物质,遇空气发生反应的化学方程式是:4Fe+3O2+6H2O=4Fe(OH)3 , 该过程放热。
【实验1】验证“暖宝宝”中含有铁粉。
打开一袋“暖宝宝”,将其中粉末倒入烧杯中,用磁铁与之充分接触,发现有黑色粉末被吸引;再将吸出的黑色粉末撒在了酒精灯火焰上,意外地发现粉末燃烧,火星四射。
证明“暖宝宝”中确实含有铁粉
-
(1) 【现象与讨论】
铁丝在空气中不能燃烧,而铁粉在空气(酒精灯火焰)中能燃烧,这是因为
。
-
(2) 【实验2】测定空气中氧气的体积分数。
小组同学设计了实验(装置如下图所示):

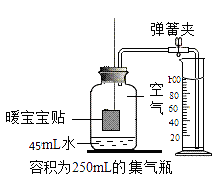
实验步骤:
①如左图所示连接好装置,然后,观察到,说明装置的气密性良好
②在容积为VmL(盖好塞子后测得)的集气瓶内,先加入45mL水,再用线吊着足量的“暖宝宝”贴(其体积不计),迅速把塞子塞紧,并振荡并静置一段时间后(保证瓶内氧气能完全消耗完),待松开弹簧夹,水进入集气瓶内。
-
(3) 【结果处理】
实验过程中,还需要测定的数据有:量筒中水面开始前的读数V1mL、结束后的读数V2mL。该实验中,测定出的空气中氧气的体积分数的表达式为。
-
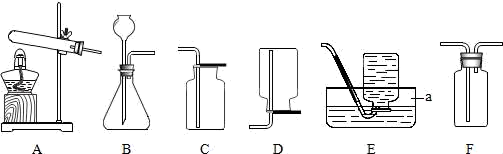
(1) 写出标号仪器名称:a.
-
(2) 在A装置中加入高锰酸钾制备氧气的化学方程式是.
-
(3) 实验室制取二氧化碳的化学方程式为,其发生装置是(填序号)若要收集干燥的CO2则需要在装置F中加入(填物质名称)将气体通过后F再用(在A~E中选择)装置收集气体.
-
(4) 赵斌钰同学想验证CO2的性质,他将B、F装置连接,在F装置中加入澄清石灰水在B装置中加入足量浓盐酸与石灰石,结果发现石灰水不浑浊,原因是(装置气密性良好,试剂未变质).
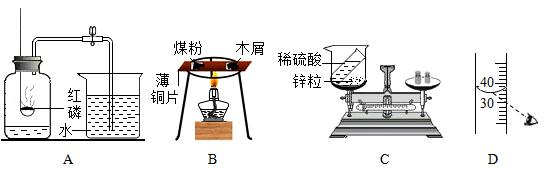
-
(1) 图A所示实验结束后,进入集气瓶中水的体积小于瓶内原气体体积的五分之一,造成该现象的原因是(答出一条即可)。
-
(2) 图B所示实验观察到木屑先燃烧,燃烧的顺序说明燃烧的条件之一是。
-
(3) 图C所示实验不能验证质量守恒定律的原因是。
-
(4) 配制一定质量分数的氯化钠溶液,按图D所示量取溶剂,其他操作均正确,最终导致配制的溶液溶质的质量分数(填“偏大”、“偏小”或“不变”)。
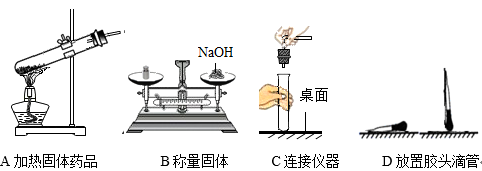
-
(1) 用B操作称取固体的质量与实际相比(填“偏大”或“偏小”)。
-
(2) C操作可能造成的不良后果是。
-
(3) D操作可能造成的后果是。
小芳同学研究反应2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑中NaHCO3与CO2之间量的关系。
-
(1) 理论计算:1.26gNaHCO3粉末与足量稀硫酸反应,计算生成CO2的质量(写出计算过程)。
-
(2) 实验分析:小芳用如图装置进行实验,向盛有足量稀硫酸的锥形瓶中加入1.26g NaHCO3粉末,完全反应至不再产生气泡。称取反应前后质量如下表,发现反应前后质量变化值(填“大于”、“小于”或“等于”)生成CO2质量的理论值,原因可能是。
反应前
反应后
NaHCO3/g
锥形瓶+稀硫酸/g
锥形瓶+反应后溶液/g
1.26
24.59
25.36
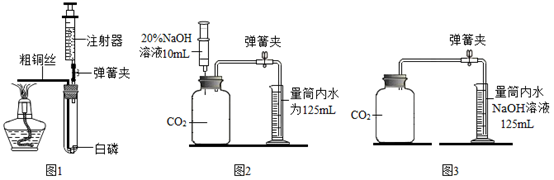
(实验步骤)①用弹簧夹夹紧胶皮管,加热粗铜丝,观察现象;②检查装置的气密性;③装药品,将注射器活塞调整到合适位置,连接好仪器;④燃烧结束后,打开止水夹,观察注射器活塞的移动情况。
-
(1) 上述实验步骤正确的操作顺序是,检查气密性的方法是:打开弹簧夹,将注射器活塞向上拉到一定的刻度,松开手,若说明装置气密性良好.
-
(2) 通过粗铜丝来点燃白磷,是利用了铜的性,该实验发生的主要反应的文字表达式为(不考虑铜与氧气的反应).
-
(3) 实验过程中可以观察到注射器活塞(填字母)
A 向上移动 B 向下移动 C 先向上移,再向下移 D 先向下移,再向上移
-
(4) 已知试管容积为50mL,加热前注射器活塞至少应调整到mL(填整数)
-
(5) 小明用125mL的集气瓶通过向上排空气法收集二氧化碳气体,但忘记了验满,为了测定这瓶气体中CO2的体积分数,设计图2装置进行实验(装置气密性良好)。
(查阅资料)NaOH能与CO2反应生成碳酸钠和水,碳酸钠易溶于水
(实验操作)将注射器内的氢氧化钠溶液全部注入集气瓶内,轻轻地振荡集气瓶,打开弹簧夹,量筒内的水沿导管流入集气瓶。实验结束后,量筒中剩余水的体积为35mL
(实验结果)这瓶气体中二氧化碳的体积分数为(填字母)。
A 72% B 80% C 90%
(交流反思)小丽提出,仅利用图3所示装置,在不添加任何试剂的前提下,也能测得集气瓶中CO2的体积分数。为达到实验目的,操作方法是。
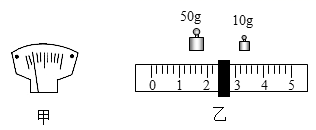
-
(1) 用量筒量取8mL液体,在读数时俯视量筒刻度,那么所量取液体实际体积8mL (选填“大于”“小于”或“等于)”。
-
(2) 测定空气中氧气的体积分数时,所用红磷的量偏少,那么所测氧气的体积分数(填偏大、偏小或不变,下同) 。
-
(3) 用一定量的过氧化氢溶液制取氧气时,所用二氧化锰的量偏少,那么所制得氧气的质量。
-
(1) 液体药品通常保存在里,取一定量液体时,通常用量筒,实验室有5mL、10mL、20mL、50mL、100mL的量筒,现要量取15mL的盐酸,应取mL的量筒,量液时量筒必须平放,视线要与量筒内液体的保持水平;
-
(2) 若某同学量取液体时俯视量筒,读出读数为15mL,则实际液体体积为15mL(填“>”、“<”或“=”)。
-
(1) Ⅰ:在农业上通常用12%的氯化钠溶液选种。实验室欲配制该质量分数的溶液60g,操作如图,请回答下列问题:
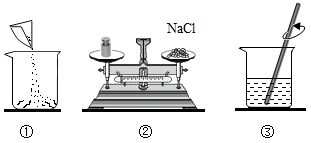
请用图中的序号表示配制溶液的正确操作顺序。
-
(2) 认真观察②,其中的不正确操作是:。若不进行改正,其他操作步骤正确,则所配溶液的溶质的质量分数(填“大于”、“小于”或“等于”)12%。
-
(3) 改正②不正确后,若配制所得的氯化钠溶液溶质质量分数偏小,可能的原因是 。(填字母序号)A . 转移已称好的氯化钠固体时,部分洒落在烧杯外 B . 用量筒量取水时俯视读数 C . 转移已配好的溶液时,有少量溶液溅出
-
(4) Ⅱ:根据下面NaNO3在不同温度时的溶解度表回答问题。(忽略溶解时的热量变化)
温度/℃
10
20
30
40
50
60
70
80
溶解度/g
80.8
87.6
94.9
103
113
124
136
149
20℃时,将90 g NaNO3固体加入盛有100g水的烧杯中,充分搅拌后,得到溶液的质量为g。给烧杯加热,使溶液温度升至40℃时,溶液中溶质与溶剂的最简质量比为。
-
(5) 80℃时,将249 g NaNO3饱和溶液降温至℃时,溶液质量变为224g。
-
(6) 50℃时将200g溶质质量分数为50%的NaNO3溶液变为该温度下的饱和溶液,至少应向溶液中再加入g NaNO3固体。
-
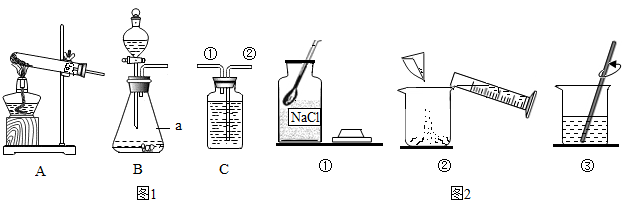
(1) 写出图1有关标号仪器的名称a。
-
(2) 实验室用图1中的A装置制取氧气的化学方程式是,若用盛满水的C装置收集氧气,应从导管(填①或②)通入。
-
(3) CO2不能用排水法收集的原因是。
-
(4) 如图2是小明同学配制100g、10%NaCl溶液的实验操作示意图。下列操作会导致溶液溶质质量分数偏小的是____(填字母)。A . 转移溶液的过程中溶液有洒落 B . 烧杯用水洗涤后就使用 C . 量取水时仰视量筒内凹液面最低处 D . 所用砝码已生锈
-
(1) 【提出猜想】猜想I:气体产物是CO2 , 猜想Ⅱ:气体产物是CO,猜想Ⅲ:气体产物是。
-
(2) 【查阅资料】氮气不能与炭粉及氧化铜反应。
【设计方案】将一定量氧化铜在隔绝空气的环境下与过量炭粉充分反应,用实验中测得的有关物质的质量进行分析、判断。
【进行实验】用如图所示装置进行实验。
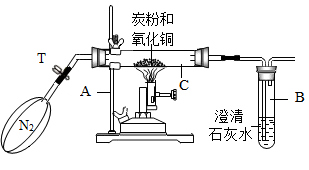
首先称得玻璃管C的质量为48.5g,再称取3.2g氧化铜和2.0g炭粉,加到玻璃管C中、连接好装置,通一段时间氮气,再夹紧弹簧夹T,点燃酒精喷灯加热。待玻璃管C中固体质量不再变化时,称得玻璃管C与残留固体共52.74g。
定性分析:
①若猜想I成立,写出碳与氧化铜反应的化学方程式。
②若猜想Ⅱ成立,则该装置的不足之处是。
③连接好装置,先通一段时间氮气的目的是。
④玻璃管C中的现象是。
-
(3) 定量分析:根据实验数据计算,实验中实际获得气体中碳元素和氧元素的质量比为。
【得出结论】猜想(选填“I”或“Ⅱ”或“Ⅲ”)成立,理由是。



