盐的化学性质 知识点
条件:(1)活动性顺序中前面的金属与后面金属的盐发生反应;(2)钾、钠、钙除外;(3)盐需可溶
2、酸+盐酸+盐
3、碱+盐碱+盐
4、盐+盐盐+盐
注意:酸碱盐间的反应都属于复分解反应,需按复分解反应条件进行判断。
盐的化学性质 知识点题库
【实验探究一】过碳酸钠的性质探究
-
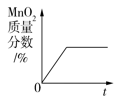
(1) 取少量“鱼浮灵”于试管中,加适量的水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡.将带火星的木条伸入试管,木条复燃,说明有 (填化学式)生成.
-
(2)
取实验(1)中上层清液,测得溶液pH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清的石灰水中,出现浑浊现象,说明有二氧化碳生成.写出二氧化碳与澄清石灰水反应的化学方程式 .
结论:过碳酸钠具有Na2CO3和双氧水的双重化学性质.
【实验探究二】“鱼浮灵”样品的组成测定
利用如图所示装置进行“鱼浮灵”样品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响).
查阅资料:①活性氧含量是指样品中能转化为氧气的氧元素的质量分数.“鱼浮灵”中活性氧含量≥13.0%是一等品,13.0>活性氧含量≥10.5%是合格品.②过碳酸钠能与酸反应放出二氧化碳和氧气.

-
(3) 实验前先缓慢通入N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2 . 实验前先缓慢通入N2一段时间的目的是 .
-
(4) 装置B的作用 (填字母代号).
a.除去气体中水蒸气 b.便于观察和控制气流速度
-
(5) 若没有装置E,会导致x:y的值 (填“偏大”或“偏小”).
-
(6) 实验测得C装置中铜网增重1.2g,D装置增重2.2g.该产品中活性氧含量为 %(计算结果精确到0.1%);属于 (填“一等品”或“合格品”);x:y= .
学习完“酸、喊、盐的性质”后,老师将两瓶未贴标签的饱和石灰水、饱和碳酸钠溶液摆放在实验桌上,让同学们区分.下面是“雄鹰小组”同学们的探究过程:

-
(1) 【讨论交流】
李壮:区分两种物质的原理是:依据物质的性质,选择一种试剂与两种物质混合,产生两种 (组长)不同的现象.大家椐此来说一说,区分这两种溶液应选用哪种试剂,并说明理由;
王志:我认为可以选择稀盐酸,理由是稀盐酸与碳酸钠反应有气泡产生,稀盐酸与氢氧化钙反应无明显现象.
马凌:我选择的是碳酸钠溶液.理由是 .
张云:马凌,你说的我没有听懂,你能再给我讲一遍吗?
在大家的帮助下,张云不但弄明白了,还选出了其他两种溶液,如溶液和溶液,最后得到大家的赞许.
-
(2) 【实验探究】
大家按照王志的方案进行了如图所示的实验:
(1)实验中同学们根据现察到的现象,判断出甲试管中原溶液为碳酸钠溶液,乙试管中原溶液为石灰水.
(2)大家对乙试管中现有溶液的溶质成分产生了探究兴趣.马凌经过认真思考后,又选择碳酸钠溶液作为检验试剂,进行了如下实验:
①马凌从乙试管中取少溶液加入到另一支新试管中,再向此新试管中加入足量的碳酸钠溶液,观察到只有白色沉淀生成.于是,他得出结论:“溶液中的溶质有氢氧化钙”.但组长李壮对这个结论产生质疑,理由是 (用化学方程式表示)
②大家讨论完李壮的质疑后,制定出测定溶液酸碱度的方法来验证他的质疑,并査阅资料得知氯化钙溶液呈中性,大家都鼓励张云来做实验.张云测出乙试管中剩余溶液的pH 7 (填“>”、“<”或“=”),证实了马凌的结论是错误的.
-
(3) 【反思评价】
判断反应后溶液中溶质的成分,除要考虑生成物外,还需考虑 .
探究活动结束了,同学们充分体验到合作探究的乐趣和学习成功的喜悦!
选项 | 实验内容 | 操作或所用试剂 |
A | 鉴别铁粉和木炭粉 | 观察颜色 |
B | 鉴别氯化铵和氯化钾 | 加熟石灰,混合研磨 |
C | 除去铜中混有的氧化铜 | 加过量稀硫酸,过滤 |
D | 除去氧化钙中混有的碳酸钙 | 高温煅烧 |
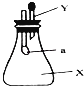
如图所示的锥形瓶内充满气体X,胶头滴管内盛有液体Y.挤压胶头滴管,使液体Y进入瓶中,振荡,一会儿可见套在玻璃管下端的小气球a鼓起.气体X和液体Y可能是( )
①取适量样品放入试管中,滴加酚酞溶液,溶液变成红色,再向试管中逐滴加入过量的氢氧化钡溶液,观察到有白色沉淀A产生,过滤,所得滤液B为红色.
②取白色沉淀A加入过量的稀盐酸,观察到有气泡产生,并且有不溶物.
③取滤液B加入过量的稀硝酸和过量的硝酸银溶液,得到溶液C和白色沉淀
-
(1) 由实验可知:该样品中一定含有的物质(写化学式,下同),一定不含有的物质是.
-
(2) 在实验③中加入过量的稀硝酸的目的是;
-
(3) 溶液C中,除了酚酞以外,一定含有的溶质有;
-
(4) 为了进一步探究样品中可能含有的物质确实存在,可以补充实验操作和现象(选其中一种可能含有的物质)。
-
(1) 下列是实验室常见气体的制取及收集装置图.
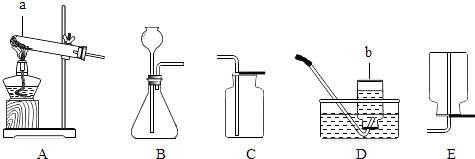
①写出标有序号的仪器名称:a,b
②实验室用过氧化氢溶液与二氧化锰粉末来制取O2 , 其中二氧化锰的作用是,应选用的制气装置是(填编号)收集O2不能选用的装置是(填编号)
-
(2) 柳州生产的两面针成人牙膏中摩擦剂的主要成分是碳酸钙,现通过以下实验装置测定碳酸钙的质量分数(假设牙膏的其它成分与盐酸不反应)
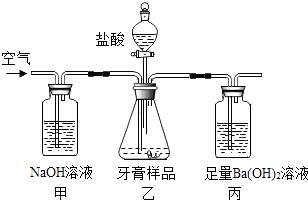
①碳酸钙属于(选填“酸”“碱”或“盐”)乙装置中碳酸钙与盐酸反应的化学方程式为
②下列措施中不能提高测定准确度的是(填序号)
A.缓慢地逐滴滴加盐酸
B.在甲乙间增加装有浓硫酸的洗气瓶.
C.在乙丙间增加装有饱和碳酸氢钠溶液的洗气瓶.
D.在乙装置反应结束后仍继续通入空气
③若称取的牙膏样品为ag,丙装置中的沉淀经干燥后质量为bg,则样品中碳酸钙的质量分数为%(用含a,b的代数式表示)
④若不测定丙装置中沉淀的质量,而通过测定丙装置在实验前后的质量差来计算碳酸钙的质量分数,会导致测定的结果明显偏高,原因是.
选项 | 物质 | 杂质 | 除杂方法 |
A | CO2 | 水蒸气 | 通入浓硫酸中 |
B | NaCl溶液 | NaOH溶液 | 加入适量BaCl2溶液,过滤 |
C | 铁粉 | 铜粉 | 加入足量的稀硫酸,过滤 |
D | CaO | CaCO3 | 加入适量稀盐酸,过滤 |
选项 | 方法 | 科学原理 |
A | 喝完汽水打嗝 | 温度升高气体溶解度减小 |
B | 醋除去热水瓶中的水垢 | 水垢能和醋酸反应而溶解 |
C | 用汽油洗涤油污 | 油污能与汽油发生乳化作用 |
D | 铝制容器不能盛酸性物质 | 酸性物质会破坏铝的氧化膜,进而腐蚀金属铝 |
-
(1) 【提出猜想】他们各自所得滤液中溶质的成分有如下几种可能:
A.NaOH B.Na2CO3、Ba(OH)2、NaOH C. D.Na2CO3和 NaOH
-
(2) 【讨论交流】上述猜想中,肯定不成立的是(填猜想序号),其理由是
-
(3) 【实验探究】甲、乙两同学为了验证各自所得滤液的成分,分别进行了如下实验:
实验操作
实验现象
实验结论
甲同学
取少量滤液于试管中,加入足量的溶液
滤液中溶质的成分与猜想C对应
乙同学
取少量滤液于试管中,加入足量的Na2CO3溶液
无明显实验现象
滤液中溶质的成分与猜想A对应
-
(4) 【反思与评价】经过讨论,大家一致认为甲同学的实验结论是正确的,乙同学的实验结论不一定正确,请你帮乙同学设计实验,进一步确定乙同学得到的滤液中溶质的成分.
实验操作及实验现象
实验结论
滤液中溶质的成分与猜想对应
①除去二氧化碳中混有的少量氧气,可以通入一氧化碳后点燃,将氧气转化为二氧化碳
②实验室用6%的氯化钠溶液配制3%的氯化钠溶液,量取6%的氯化钠溶液时俯视读数,若其他操作均正确,则所配溶液中溶质的质量分数大于3%
③某固体可能由氯化钠、硫酸钠、氯化钡、氯化镁、硫酸钾中的一种或几种组成,取少量该固体,加入足量的稀氢氧化钠溶液,产生白色沉淀,过滤,向沉淀中加入足量稀硝酸,沉淀部分溶解,则该固体的组成有5种情况
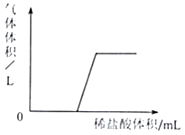
④某碳酸钠溶液中可能含有另一种溶质,取一定量该溶液,逐滴滴加稀盐酸,产生气体的体积与加入稀盐酸的体积关系如图所示,则该碳酸钠溶液中一定含有氢氧化钠.
-
(1) 上述过程中存在多个复分解反应,其中生成水的有个。
-
(2) 加入Na2CO3溶液的作用是什么?
-
(3) 操作③得到固体的成分有哪些?(写出化学式)
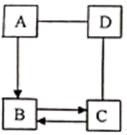
-
(1) A和D反应的化学方程式是。
-
(2) C物质的用途(写出一种即可)。
-
(3) A转化为B的化学方程式是。
 B . 将水通电电解一段时间
B . 将水通电电解一段时间 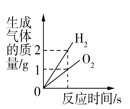 C . 向一定量的氢氧化钠和氯化钡的混合溶液中滴加稀硫酸
C . 向一定量的氢氧化钠和氯化钡的混合溶液中滴加稀硫酸  D . 一定质量的稀硫酸中不断加入氧化铜固体
D . 一定质量的稀硫酸中不断加入氧化铜固体 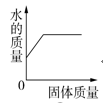
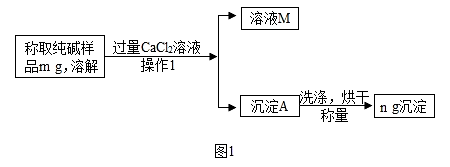
-
(1) (方案一)沉淀分析法(如图1所示)则:
溶液M中含有的阳离子有;
-
(2) 确定CaCl2溶液是否过量的方法是____;A . 向溶液M中滴加Na2CO3溶液,如果有沉淀,则过量 B . 向溶液M中滴加CaCl2溶液,如果有沉淀,则过量
-
(3) 若沉淀A没有洗涤烘干,导致Na2CO3的质量分数(填“偏大”、“偏小”或“不变”).判断沉淀A洗净的方法是:取最后一次洗涤所得滤液,滴加AgNO3溶液,若(填“有”或“无”)白色沉淀,则洗涤干净。
-
(4) 样品中Na2CO3的质量分数为(用字母m、n的代数式表示)。
-
(5) (方案二)气体分析法(如图2所示)
利用下图所示实验装置和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的)。

打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的,再接上装置C和D。
-
(6) 关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中产生气体的化学方程式为。
-
(7) 待装置A中的反应结束后,再打开止水夹K,继续通入已除去CO2的空气一会儿,目的是。装置(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数。
反思:若没有装置D,将会使测定结果(选填“偏大”或“偏小”)。

回答下列问题:
-
(1) 从流程图中推知:SiO2具有的化学性质是。
-
(2) 氧化铁与盐酸反应的化学方程式为。
-
(3) 滤渣3中除有Ca(OH)2外,还有(填化学式,下同)。
-
(4) 产品中的杂质除极少量H2O外,最有可能含的是。
-
(1) “水球迅速变蓝”和“闻到阵阵香气”都可说明微粒处于(选填“运动”或“静止”)状态。
-
(2) 碳酸氢钠的化学式为,柠檬酸溶液中因含有大量的(选填“H+”或“OH-”)而呈酸性,两者在水球中产生的气体可能是。
-
(3) 天宫中实验后水球中的水必须净化再利用,经过(选填“过滤”或“蒸馏”)可得到能饮用的水。



