氧族与碳族及其应用 知识点题库
(1)家庭装修所用的复合板材中常会放出对人体有严重危害的物质,这种有害物质只要是指 (填名称).
(2)天然水中含有的细小悬浮颗粒可以用明矾做进行净化处理,明矾水解得到的 可以吸附细小悬浮颗粒.
(3)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量.为控制大气中二氧化硫的排放,常采取的措施是在煤炭中加入石灰石粉末对化石燃料进行脱硫处理,其原理用方程式可表示为

-
(1) 向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I﹣ , 其离子方程式为;该操作将I2还原为I﹣的目的是.
-
(2) 操作X的名称为.
-
(3) 氧化时,在三颈烧瓶中将含I﹣的水溶液用盐酸调至pH约为2,缓慢通入Cl2 , 在40℃左右反应(实验装置如图二所示).实验室控制在较低温度下进行的原因是;锥形瓶里盛放的溶液为.
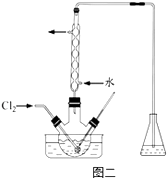
-
(4) 已知:5SO32﹣+2IO3﹣+2H+═I2+5SO42﹣+H2O
某含碘废水(pH约为8)中一定存在I2 , 可能存在I﹣、IO3﹣中的一种或两种,请补充完整检验含碘废水中是否含有I﹣、IO3﹣的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液.
-
(1) 引起温室效应的主要气体是(填序号,下同). ①SO2 ②CO2
-
(2) 能形成酸雨的物质是①硫的氧化物 ②碳的氧化物 ③氮的氧化物.
-
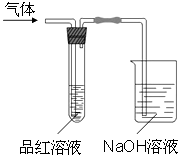
(1) 向第一套装置中通入一段时间的SO2 , 观察到试管中的品红溶液褪色,然后再加热试管,溶液(填“恢复”或“不恢复”)红色;
-
(2) 向第二套装置中通入一段时间的Cl2 , 观察到试管中的品红溶液也褪色,然后再加热试管,溶液(填“恢复”或“不恢复”)红色;
-
(3) 由以上两个实验可以说明SO2和Cl2的漂白原理(填“相同”或“不相同”);
-
(4) Cl2通入品红溶液中,生成的具有漂白性的物质是填“HCl”或“HClO”).
-
(1) 烟气脱硫、脱硝的环境意义是;
-
(2) 一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3
 7N2+12H2O
7N2+12H2O ①上述反应中被还原的元素是(填元素符号),反应中每转移3mol电子,生成标准状况下N2的体积为;
光
②超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ、O3
 O+O2
O+O2Ⅱ、NO+O3→NO2+O2
Ⅲ、NO2+O→NO+O2
上述反应中NOx所起的作用是;
-
(3) 下表列出了2种燃煤烟气脱硫方法的原理.
方法Ⅰ
用氨水将SO2转化为NH4HSO3 , 再氧化成(NH4)2SO4
方法Ⅱ
用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫
①方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3 , 是利用了SO2的
性质(选填字母编号)
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物
②方法Ⅱ主要发生了下列反应:
2CO(g)+SO2(g)═S(g)+2CO2(g)△H1=8.0kJ•mol﹣1
2H2(g)+SO2(g)═S(g)+2H2O(g)△H2=90.4kJ•mol﹣1
2CO(g)+O2(g)═2CO2(g)△H3=﹣566.0kJ•mol﹣1
某企业脱硫前每天排放含SO2体积分数为m,体积n升的尾气(折算成标准状况),若回收利用,理论上可以回收克硫一天.
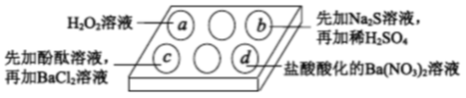
下列关于实验现象的解释或结论正确的是( )
| 选项 | 实验现象 | 解释或结论 |
| A | a中无明显现象 | Na2SO3和H2O2一定不发生反应 |
| B | b中加稀H2SO4后才产生淡黄色沉淀 | SO32−和S2−两种离子一定不能大量共存 |
| C | c中加BaCl2溶液后产生白色沉淀且红色褪去 | Ba2++ SO32− == BaSO3↓,使SO32−水解平衡逆向移动,红色褪去 |
| D | d中产生白色沉淀 | 原Na2SO3溶液中含有SO42− |
| 选项 | 操作 | 现象 | 结论 |
| A | 向石蕊溶液中通入SO2 | 溶液褪色 | SO2具有漂白性 |
| B | 向KMnO4酸性溶液中通入乙烯 | 溶液褪色 | 乙烯能发生加成反应 |
| C | 铝片先用砂纸打磨,再加入到浓硝酸中 | 无明显现象 | 浓硝酸具有强氧化性,常温下,铝被浓硝酸钝化 |
| D | 向AgCl悬浊液中滴入NaI溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| 实验方案 | 实验I: | 实验II: |
| 实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
①向沸水中逐滴加入少量饱和  溶液,可制得
溶液,可制得 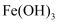 胶体
胶体
②用pH试纸测得氯水的 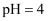
③除去  气体中的
气体中的  ,可将气体通入饱和食盐水中
,可将气体通入饱和食盐水中
④  能与
能与  溶液、
溶液、 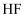 溶液反应,所以
溶液反应,所以  是两性氧化物
是两性氧化物
⑤铅酸蓄电池放电时的正极电极反应为 
⑥由  可推出
可推出 
 B . 向某溶液中加入稀硝酸酸化的硝酸银溶液产生白色沉淀,则原溶液中一定含有
B . 向某溶液中加入稀硝酸酸化的硝酸银溶液产生白色沉淀,则原溶液中一定含有 C . 向某溶液中滴入氯水后,再滴入
C . 向某溶液中滴入氯水后,再滴入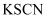 溶液,溶液变红,则原溶液中一定含有
溶液,溶液变红,则原溶液中一定含有 D . 向某溶液中加入稀盐酸酸化的氯化钡溶液产生白色沉淀,则原溶液中一定含有
D . 向某溶液中加入稀盐酸酸化的氯化钡溶液产生白色沉淀,则原溶液中一定含有
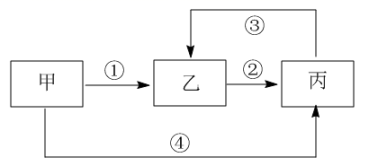
-
(1) 若甲为气态氢化物,乙为黄色固体,写出此时反应①的化学方程式。
-
(2) 若甲为两性氧化物,乙的水溶液呈酸性,请用离子方程式写出乙的水溶液呈酸性的原因,写出此时反应④的离子方程式。
-
(3) 若甲为金属单质,反应④为置换反应,则往乙溶液中滴加KSCN,溶液变为:往丙的溶液中滴加(填化学式),产生蓝色沉淀。
-
(4) 若甲为气体单质,乙为含有极性共价键的非极性分子,请写出甲的分子式,乙的电子式。


 存在),产生能使带火星的木条复燃的无色气体
存在),产生能使带火星的木条复燃的无色气体


