pH的简单计算 知识点题库
-
(1) 当三种酸的pH相同时,其物质的量浓度由大到小的顺序为:;
-
(2) 当三种酸的物质的量浓度相同时,其pH由大到小的顺序为:;
-
(3) 中和等体积、等物质的量浓度的NaOH溶液时,所需等物质的量浓度的三种酸溶液的体积关系为:;
-
(4) 体积和物质的量浓度相同的三种酸溶液,分别与同浓度的NaOH溶液反应,要使反应后的溶液呈中性,所需NaOH溶液的体积关系为:;
-
(5) 当三种酸溶液pH相同、体积也相同时,分别加入足量锌,相同状况下产生气体的体积关系为;
-
(6) 当三种酸溶液的物质的量浓度相同、体积也相同时,分别加入足量锌,相同状况下产生气体的体积关系为;
-
(7) 将pH相同的三种酸溶液均稀释10倍后,pH的大小关系为 .
-
(1) 常温下,将1mL 0.05mol/L的H2SO4溶液加水稀释至100mL,稀释后溶液的pH=.若将pH=5的硫酸溶液稀释500倍,稀释后溶液中C(SO42﹣):C(H+)=
-
(2) 某温度时,测得0.01mol•L﹣1的NaOH溶液的pH为11,该溶液与pH=5的HCl溶液等体积混合(混合后溶液体积变化忽略不计),混合后溶液pH=.
-
(3) 常温下,pH=5的H2SO4溶液中由水电离出的H+的浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+的浓度为c2 , 溶液中
 =.
=.
-
(4) 常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a:b=.若所得混合溶液pH=12,则a:b=.
-
(1) (一)现有如下各化合物:①酒精,②氯化铵,③氢氧化钡,④氨水,⑤蔗糖,⑥高氯酸,⑦氢硫酸,⑧硫酸氢钾,⑨磷酸,⑩硫酸.
请用以上物质的序号填写下列空白.
属于电解质的有.
-
(2) 属于强电解质的有.
-
(3) 属于弱电解质的有.
-
(4) (二)一定温度下有:a.盐酸 b.硫酸 c.醋酸三种酸.
当其物质的量浓度相同时,c(H+)由大到小的顺序是.
-
(5) 同体积、同物质的量浓度的三种酸,中和NaOH能力的顺序是
-
(6) 当c(H+)相同、体积相同时,同时加入锌,若产生相同体积的H2(相同状况),则开始时的反应速率,反应所需时间.
-
(7) 将c(H+)相同的三种酸均稀释10倍后,c(H+)由大到小的顺序是.
-
(1) 该温度下1mol•L﹣1的NaOH溶液的pH=,由水电离出的c(OH﹣)= mol•L﹣1 .
-
(2) 该温度下,将pH=11的NaOH溶液aL与pH=1的HCl溶液bL混合(忽略混合后溶液体积的变化),若所得溶液的pH=10,则a:b=.
-
(1) 水质优劣直接影响人体健康.天然水在净化处理过程中加入的混凝剂可以是(填一种物质的名称),其净水作用的原理是.混凝剂难以清除溶解于水中的有机物、无机物、微生物,混凝剂沉淀后还需要.
-
(2) 硬水的软化指的是.
-
(3) 硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO).若某天然水中c(Ca2+)=1.2×10﹣3mol/L,c(Mg2+)=6×10﹣4mol/L,则此水的硬度为.
-
(4) 若(3)中的天然水还含有c(HCO3﹣)=8×10﹣4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2g,后加入Na2CO3g.
-
(5)
如图是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极.

①隔膜A是(填“阴”或“阳”)离子交换膜.
②某种海水样品,经分析含有大量的Na+、Cl﹣ , 以及少量的K+、SO42﹣ . 若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc , 则其大小顺序为.

-
(1) 废铁渣进行“粉碎”的目的是。
-
(2) 在实验室进行过滤操作时,所用到玻璃仪器有。
-
(3) “酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等条件,其中酸浸温度对铁浸取率的影响如下表所示:
温度(℃)
40
60
80
100
120
铁浸取率(%)
50
62
79
92
83
已知:在一定温度下,Fe3+在pH=2开始沉淀,pH=3.7沉淀完全。
①酸浸时应控制溶液的pH,其原因是。
②酸浸时通入O2的目的是。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是。
-
(4) 滤渣的主要成分为(填化学式)。
-
(5) “Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为;
已知称取2.60 g聚硅酸铁产品,加入硫酸,再加入足量SnCl2 , 用0.2000 mol/L K2Cr2O7标准溶液滴定,消耗K2Cr2O7溶液的体积为20.00 mL,则聚硅酸铁产品中铁元素的百分含量为
(结果保留两位有效数字)。
-
(1) 相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为: pH(甲)pH(乙)(填“大于”、“小于”或“等于”)。
-
(2) 各取25mL的甲、乙两溶液,分别用等浓度的 NaOH 稀溶液中和至 pH=7,则消耗的 NaOH 溶 液的体积大小关系为:V(甲)V(乙)(填“大于”、“小于”或“等于”)。
-
(3) pH=2的醋酸溶液中由水电离出的c(H+)0.01mol/LHCl溶液中由水电离出的c(H+)。(填“>”、“<”、或“=”)
| 选项 | 实验操作和现象 | 结论 |
| A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
| B | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体 | Na2O2没有变质 |
| C | 室温下,用pH试纸测得:0.1 mol/LNa2SO3溶液的pH约为10;0.1 mol/L NaHSO3的溶液的pH约为5 | HSO3-结合H+的能力比SO32-弱 |
| D | 取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液,最终无淡黄色沉淀 | CH3CH2Br没有水解 |
-
(1) 常温下,某电解质溶解在水中后,溶液中水电离的c(H+)=1×10-9 , 则该电解质可能是____(填序号)。A . CuSO4 B . HCl C . Na2S D . NaOH E . K2SO4
-
(2) 常温时,取0.1mol·L-1 HX溶液与0.1mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH=8。
①混合溶液中由水电离出的c(OH-)与0.1mol/LNaOH溶液中由水电离出的c(OH-)之比为。
②已知NH4X溶液呈中性,将HX溶液加入到Na2CO3溶液中有气体放出。试推断NH4HCO3溶液的pH7(填“>”“<”或“=”)。
-
(3) T℃时,测得0.01mol·L-1 NaOH溶液的pH=10,则此温度下水的Kw=。在此温度下,将0.01mol·L-1 H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液pH=11,则Va∶Vb=(忽略溶液混合时体积的变化)。
 )∶c(SO
)∶c(SO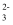 )≈10时,吸收能力下降,需要加热再生为Na2SO3溶液。已知Ka1(H2SO3)=10-1.9 , Ka2(H2SO3)=10-7.2 , 下列说法错误的是( )
)≈10时,吸收能力下降,需要加热再生为Na2SO3溶液。已知Ka1(H2SO3)=10-1.9 , Ka2(H2SO3)=10-7.2 , 下列说法错误的是( )
 ) +2c(H2SO3)
B . Na2SO3溶液吸收SO2的离子方程式为:SO
) +2c(H2SO3)
B . Na2SO3溶液吸收SO2的离子方程式为:SO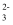 +SO2+H2O=2HSO
+SO2+H2O=2HSO C . 当c(HSO
C . 当c(HSO ):c(SO
):c(SO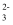 )=10时,此时吸收液的pH=6.2
D . 与原Na2SO3溶液相比,吸收液充分分解放出SO2再生后吸收SO2能力几乎不变
)=10时,此时吸收液的pH=6.2
D . 与原Na2SO3溶液相比,吸收液充分分解放出SO2再生后吸收SO2能力几乎不变



