物质结构与性质 知识点题库
2016年IUPAC命名117号元素为Ts(中文名“ ![]() ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
A . Ts是第七周期第ⅦA族元素
B . Ts的同位素原子具有相同的电子数
C . Ts在同族元素中非金属性最弱
D . 中子数为176的TS核素符号是 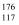 Ts
Ts
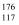 Ts
Ts
Cu3N的晶胞结构如图,N3﹣的配位数为,Cu+半径为acm,N3﹣半径为bcm,Cu3N的密度为g•cm﹣3 . (阿伏加德罗常数用NA表示,Cu、N相对分子质量为64、14)

下面的排序不正确的是( )
A . 晶体熔点的高低: >
>  B . 硬度由大到小:金刚石>碳化硅>晶体硅
C . 熔点由高到低:Na>Mg>Al
D . 晶格能由大到小:NaF>NaCl>NaBr>NaI
B . 硬度由大到小:金刚石>碳化硅>晶体硅
C . 熔点由高到低:Na>Mg>Al
D . 晶格能由大到小:NaF>NaCl>NaBr>NaI
 >
>  B . 硬度由大到小:金刚石>碳化硅>晶体硅
C . 熔点由高到低:Na>Mg>Al
D . 晶格能由大到小:NaF>NaCl>NaBr>NaI
B . 硬度由大到小:金刚石>碳化硅>晶体硅
C . 熔点由高到低:Na>Mg>Al
D . 晶格能由大到小:NaF>NaCl>NaBr>NaI
某元素X气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素( )
A . 在周期表中处于第三周期ⅦA族
B . 在周期表中处于第2周期ⅤA族
C . 氢化物比H2O稳定
D . 常见化合价只有﹣3、+2、+3、+5价
下列关于SO2与CO2的说法中正确的是( )
A . 都是直线形结构
B . 中心原子的σ键电子对数都为2
C . S原子和C原子上都没有孤电子对
D . 两者的立体构型都是直线形
金属铁、铜及其化合物在科学研究和工业生产中具有重要的用途。下图1表示铜与氯形成化合物A的晶胞(黑球代表铜原子)。图2是Fe3+与乙酰乙酸乙酯形成的配离子B。

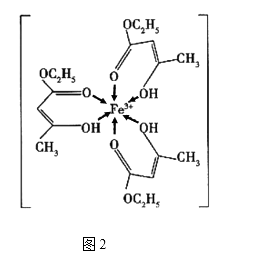
回答下列问题
-
(1) 基态Cu原子的核外电子排布式为。
-
(2) 从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)I1(Cu)(填“>“<”或“=”)
-
(3) 化合物A的化学式为,Cl原子的配位数是。
-
(4) B中碳原子的杂化轨道类型为,含有的化学键为(填字母)。
a.离子键 b.金属键 c.极性键 d.非极性键 e.配位键 f.氢键 g.σ键 h.π键
-
(5) 化合物A难溶于水,但易溶于氨水,其原因可能是;与NH3互为等电子体的分子有(写化学式,一种即可)。NH3的键角大于H2O的键角的主要原因是。
-
(6) 已知化合物A晶体的密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则该晶体中两个Cu原子之间的最短距离为nm(列出计算表达式即可)。
有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质分子在适当条件下可发生如图变化,其中B和C均为10电子分子.下列说法中错误的是( )

A . X与Z形成的某种化合物可用来杀菌消毒
B . C极易溶于B中,溶液呈碱性
C . Y与Z形成的二元化合物只含有极性键
D . A和C能发生氧化还原反应
最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
A . 全氟丙烷(C3F8)分子中既有极性键又有非极性键
B . 全氟丙烷(C3F8)的电子式为:  C . 相同压强下,沸点:C3F8<C3H8
D . 分子中三个碳原子可能处于同一直线上
C . 相同压强下,沸点:C3F8<C3H8
D . 分子中三个碳原子可能处于同一直线上
 C . 相同压强下,沸点:C3F8<C3H8
D . 分子中三个碳原子可能处于同一直线上
C . 相同压强下,沸点:C3F8<C3H8
D . 分子中三个碳原子可能处于同一直线上
下列各组性质比较中,正确的是( )
①沸点:HI>HBr>HCl>HF ②离子还原性:S2- >Cl- >Br- >I- ③酸性:HClO4> HBrO4> HIO4 ④金属性:K>Na>Mg>Al ⑤气态氢化物稳定性: HF > HCl > H2S ⑥半径:O2- >F- >Na+ >Mg2+
A . ①②③
B . ③④⑤⑥
C . ②③④
D . ①③④⑤⑥
下列粒子性质递变趋势正确的是( )
A .  B .
B . 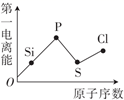 C .
C . 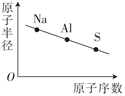 D .
D . 
 B .
B .  C .
C .  D .
D . 
下列说法一定正确的是( )
A . 分子晶体中都存在共价键
B . 当中心原子的配位数为6时,配合单元常呈八面体空间结构
C . SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D . 金属晶体的熔点都比分子晶体的熔点高
五种短周期元素A、B、C、D、E原子序数依次增大。B的最外层电子数是其电子层数的3倍;C、D、E的最高价氧化物对应水化物两两均可反应;A的单质在E的单质中能安静地燃烧,产生苍白色火焰。回答下列问题:
-
(1) B元素在元素周期表中的位置是,B、C、D形成的简单离子的半径由大到小的顺序是(用化学符号表示)。
-
(2) B与C能形成一种淡黄色的固体,其电子式为,它能用于呼吸面具的原因是(用其中一个化学方程式表示)。
-
(3) D的单质常用于焊接钢轨,请用化学方程式表示其反应原理。D、E的最高价氧化物对应水化物之间发生反应的离子方程式为。
下列过程中,共价键被破坏的是( )
A . 干冰升华
B . 氯气被活性炭吸附
C . 酒精溶于水
D . 碘化氢气体溶于水
一种由短周期主族元素组成的化合物(如下图所示),常用作氧化剂、漂白剂、消毒剂等,其中 X、Y、Z、W的原子序数依次增大,且 X、Y、Z的原子序数之和与 W的原子序数相等。下列有关叙述错误的是( )

A . 该化合物中 W和 Z的化合价分别为 +6价、-2价
B . W的氢化物具有还原性
C . 该化合物中 Y、Z、W不全满足 8电子稳定结构
D . Y的最高价氧化物的水化物为强酸
我国科学家提出用  替换可燃冰(
替换可燃冰(  )中
)中  的设想,替换过程如图所示,下列说法正确的是( )
的设想,替换过程如图所示,下列说法正确的是( )
 替换可燃冰(
替换可燃冰(  )中
)中  的设想,替换过程如图所示,下列说法正确的是( )
的设想,替换过程如图所示,下列说法正确的是( ) 
A . E代表  ,F代表
,F代表  B . 乙到丙的过程熵变大于零
C . 甲到乙的过程中释放能量
D . 笼状结构中水分子间主要靠氢键“结合”
B . 乙到丙的过程熵变大于零
C . 甲到乙的过程中释放能量
D . 笼状结构中水分子间主要靠氢键“结合”
 ,F代表
,F代表  B . 乙到丙的过程熵变大于零
C . 甲到乙的过程中释放能量
D . 笼状结构中水分子间主要靠氢键“结合”
B . 乙到丙的过程熵变大于零
C . 甲到乙的过程中释放能量
D . 笼状结构中水分子间主要靠氢键“结合”
-
(1) 图甲是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu图乙是沿立方格子对角面取得的截图。可见,Cu 原子之间最短距离x= pm,Mg原子之间最短距离y=pm。

-
(2) 一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子,其晶胞如图丁所示。其中Pb2+与图丙中的空间位置相同;若晶胞参数为anm,则晶体密度为g·cm-3

下列物质中,含有离子键的是( )
A . Cl2
B . HCl
C . CaCl2
D . HClO
原子数目和价电子总数都相等的分子或离子互为等电子体,等电子体具有相似的空间构型。下列各组分子或离子的空间构型不相似的是( )
A . O3和SO2
B . N2O和CO2
C . CO和N2
D . CS2和NO2
氮的相关化合物在材料等方面有重要用途。回答下列问题:
-
(1) 基态N原子的核外电子排布式为,第一电离能:I1(N)I1(O)(填“大于”或“小于”)。
-
(2) N及其同族的P、As均可形成类似的氢化物,NH3、PH3、AsH3的沸点由高到低的顺序为(填化学式)。
-
(3) [N5]+[AsF6]-是一种全氮阳离子形成的高能物质,其结构如图所示,其中N原子的杂化轨道类型为。

-
(4) 科学家近期首次合成了具有极性对称性的氮化物钙钛矿材料-LaWN3 , 其立方晶胞结构如图所示,晶胞中La、W、N分别处于顶角、体心、面心位置,晶胞参数为a nm。

①La与N间的最短距离为nm,与La紧邻的N个数为。
②在LaWN3晶胞结构的另一种表示中,W处于各顶角位置,则在新的晶胞中,La处于位置,N处于位置。
③设LaWN3的式量为Mr , 阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3(列出计算表达式)。
有四种元素原子的基态或激发态原子的电子排布式如下:
① ②
② ③
③ ④
④
下列说法错误的是( )
A . 元素①的一种单质可用于消毒杀菌
B . 元素②所在周期中其原子半径最大
C . 元素①③在周期表中位于第17列
D . 元素④的简单氢化物常作制冷剂
最近更新



