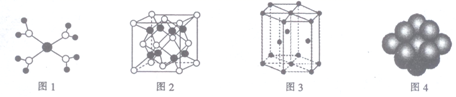
金属晶体的基本堆积模型 知识点
(1)体心立方堆积:金属原子分别占据立方晶胞的顶点位置和体心位置,空间占有率68.02%.
(2)简单立方堆积:金属原子只占据立方晶胞的顶点位置,空间占有率52.36%,是不稳定的堆积方式。
(3)六方最密堆积:金属原子是AB AB堆积方式,在第一层中,最紧密的堆积方式医|学教|育网搜集整理,是一个球与周围6个球相切,在中心的周围形成6个凹位。第二层是将球对准第一层的1,3,5位(或对准2,4,6位)。第三层是将球对准第一层的球,于是每两层形成一个周期,形成六方紧密堆积。
(4)面心立方最密堆积:第一、二层中堆积方式和六方最密堆积相同,第三层是将球对准第一层的2,4,6位,不同于AB两层的位置,这是C层。第四层再排A,于是形成ABC ABC三层一个周期。
金属晶体的基本堆积模型 知识点题库
①原子晶体中只存在非极性共价键
②稀有气体形成的晶体属于原子晶体
③干冰晶体升华时,分子内共价键会发生断裂
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤分子晶体的堆积均为分子密堆积
⑥离子晶体和金属晶体中均存在阳离子,但金属晶体中却不存在离子键
⑦金属晶体和离子晶体都能导电
⑧依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体
-
(1) 下列是钠、碘、金刚石、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是;(请用相应的编号填写)

-
(2) 已知:晶体二氧化硅可由晶体硅衍生得到;下图是晶体硅及二氧化硅的晶胞示意图:
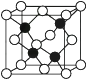
图1 晶体Si的晶胞
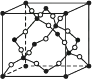
图2 晶体SiO2的晶胞
由图示可知两者形成的晶体的类型是,请写出与晶体SiO2化学键及晶体类型完全相同的两种物质的名称:;
-
(3) 干冰晶体是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心上又各有1个CO2分子,在每个CO2周围紧邻(其中a为立方体棱长)的CO2有个。
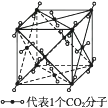
-
(1) 写出Cr的外围电子排布式。与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是。
-
(2) 根据下表Cr原子的能级电离能(I:k]/mo1)数据,解释原子逐级电离能增大的原因:。
I1
I2
I3
I4
I5
I6
I7
652.9
1590.6
2987
4743
6702
8744.9
15455
-
(3) CrCl3·6H2O有三种水合异构体,蓝绿色的[Cr(H2O)5Cl]Cl2·6H2O,绿色的[Cr(H2O)4Cl2]Cl·6H2O和紫色的,其中Cr的配体水分子也可以被NH3置换,如[Cr(NH3)5Cl]2+ , 则NH3的VSEPR模型为,N的杂化方式为,写出NH3的一种等电子体。
-
(4) CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是。
-
(5) Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是
A.Na
B.Po
C.Mg
D.Cu
②晶胞中Cr的配位数为
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3 , 阿伏加德罗常数用NA表示,则Cr的原子半径是 pm.(写出表达式即可)
含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
-
(1) 基态B原子电子占据最高能级的电子云轮廓图为;基态Cu+的核外电子排布式为 。
-
(2) 化合物(CH3)3N分子中N原子杂化方式为 ,该物质能溶于水的原因是 。
-
(3) PH3分子的键角小于NH3分子的原因是 ;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式 为。
-
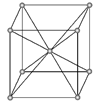
(4) 磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:

①在一个晶胞中磷原子的配位数为。
②已知磷化硼晶体的密度为ρg/cm3 , 阿伏加德罗常数为NA , 则B-P键长为pm。
③磷化硼晶胞沿着体对角线方向的投影如图2,请在答题卡上将表示B原子的圆圈涂黑。
-
(1) 现有铜锌元素的4种微粒,①锌:[Ar]3d104s2;②锌:[Ar]3d104s1;③铜:[Ar]3d104s1;④铜:[Ar]3d10。失去一个电子需要的最低能量由大到小的顺序是(填字母)。
A ④②①③ B ④②③① C ①②④③ D ①④③②
-
(2) 砷化镉(Cd3As2)是一种验证三维量子霍尔效应的材料。
①砷与卤素可形成多种卤化物,AsBr3、AsCl3、AsF3的熔点由低到高的顺序为。砷酸的酸性弱于硒酸,从分子结构的角度解释原因。
②Cd2+与NH3形成配离子[Cd(NH3)4]2+中,配体的空间构型为,画出配离子的结构式(不考虑立体构型)。
-
(3) 铬(Cr)、钼(Mo)、钨(W)位于同一副族相邻周期,且原子序数依次增大。
①基态铬原子、钼原子的核外电子排布特点相同,则基态钼原子的价层电子排布图为。
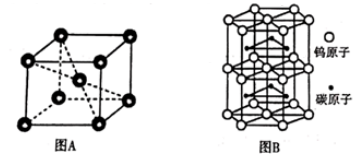
②铬的晶胞结构如图A所示,它的堆积模型为,在该晶胞中铬原子的配位数为。
③钨和碳能形成耐高温、耐磨材料碳化钨,其晶胞结构如图B所示,则碳化钨的化学式为,六棱柱的底边长为a cm,高为b cm,设阿伏加德罗常数的值为NA , 则碳化钨晶体的密度是g·cm-3(列出计算表达式)。
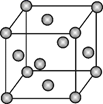
-
(1) 钼晶体的堆积方式为,晶体中粒子的配位数为。
-
(2) 构成钼晶体的粒子是,晶胞中所含的粒子数为。
-
(3) 金属钼的密度为g·cm-3。