晶体的类型与物质的性质的相互关系及应用 知识点题库
石墨由多“层”构成,质地柔软,但分离成一“层”后即成为“石墨烯”,硬度超过了金刚石,导电能力也大大超过了一般的导体,这再次验证了( )
A . 量变引起质变的规律
B . 能量守恒与转换的规律
C . 勒夏特列原理
D . 阿伏加德罗定律
下列各项比较中,正确的是( )
A . 含碳量:生铁>钢
B . 熔点:铁<汞
C . 氢氧化钙的溶解度:80℃>20℃
D . 核外电子数:钠原子<钠离子
下列叙述正确的是( )
A . 固体SiO2一定是晶体
B . 晶体有固定的组成,非晶体没有固定的组成
C . 晶体内部的微粒按一定规律呈周期性有序排列
D . 晶体的基本结构单元(晶胞)全部是平行六面体
下列物质的分类正确的是( )
A | B | C | D |
淀粉﹣混合物 | 苯酚﹣有机物 | 液氯﹣非电解质 | 胆矾﹣分子晶体 |
明矾﹣纯净物 | 纯碱﹣盐 | 碳酸钙﹣强电解质 | 食盐晶体﹣离子晶体 |
盐酸﹣化合物 | 水﹣氧化物 | 醋酸﹣弱电解质 | 金刚石﹣原子晶体 |
A . A
B . B
C . C
D . D
现有几组物质的熔点(℃)数据:
A组 | B组 | C组 | D组 |
金刚石:>3 550 | Li:181 | HF:﹣84 | NaCl:801 |
硅晶体:1 410 | Na:98 | HCl:﹣114 | KCl:770 |
硼晶体:2 300 | K:63 | HBr:﹣87 | RbCl:715 |
二氧化硅:1 710 | Rb:39 | HI:﹣51 | CsCl:645 |
据此回答下列问题:
-
(1) A组属于晶体,其熔化时克服的微粒间的作用力是
-
(2) B组晶体共同的物理性质是(填序号).
①有金属光泽 ②导电性 ③导热性 ④延展性
-
(3) C组中HF熔点反常是由于.
-
(4) D组晶体可能具有的性质是(填序号).
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
-
(5) D组晶体的熔点由高到低的顺序为:NaCl>KCl>RbCl>CsCl,其原因解释为:.
下列每组物质发生状态变化所克服的微粒间的相互作用属同种类型是( )
A . 食盐和蔗糖的熔化
B . 白磷和硫的熔化
C . 氯化铵固体和干冰受热后的气化
D . 氧化镁和金属镁的熔化
钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法正确的是( )

A . 与每个Ba2+距离相等且最近的Ba2+共有6个
B . 晶体中Ba2+的配位数为8
C . 晶体的化学式为Ba2O2
D . 该氧化物是含有非极性键的离子化合物
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中正确的是( )
A . C3N4晶体是分子晶体
B . C3N4晶体中C—N键的键长比金刚石中的C—C键的键长长
C . C3N4晶体中C、N原子个数之比为4∶3
D . C3N4晶体中粒子间通过共价键相结合
下列有关晶体的叙述中,不正确的是( )
A . 离子晶体在熔化时,离子键被破坏,而分子晶体熔化时化学键不被破坏
B . 白磷晶体中,结构粒子之间通过分子间作用力结合
C . 石英晶体是直接由硅原子和氧原子通过共价键所形成的空间网状结构的晶体
D . 构成分子晶体的结构粒子中一定存在共价键
下列各组物质的晶体中,化学键种类相同,晶体类型也相同的是( )
A . SO2与SiO2
B . CCl4与CaCl2
C . NaBr与HCl
D . CO2与H2O
N、Cu及其相关化合物用途非常广泛。回答下列问题:
-
(1) 基态铜原子的价电子排布式为。
-
(2) NH3分子的立体构型为,中心原子的杂化类型是。
-
(3) N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是,电负性最小的是。(填元素符号)
-
(4) 已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为 (填“离子晶体”或“分子晶体”,下同),CuCl为。
-
(5) 氮与铜形成的一种化合物的晶胞结构如图所示。

与每个Cu原子紧邻的Cu原子有个,阿伏加德罗常数的数值为NA , 该晶体的密度为 (列出计算式)g·cm-3。
-
(1) 比较元素非金属性的相对强弱:ClS(填“>”、“<”或“=”):用一个化学方程式说明Cl2和S氧化性的相对强弱。
-
(2) 离子化合物MgO2可用于治疗消化道疾病,各原子均满足8电子稳定结构。写出MgO2的电子式。
-
(3) CO2和SiO2均是IVA族元素氧化物,CO2常温为气态,SiO2为高熔点固体。请分析原因。
X和Y两种元素的核电荷数之和为22,X的原子核外电子数比Y的少6个。下列说法中错误的是( )
A . X的单质固态时为分子晶体
B . Y 的单质为原子晶体
C . X与Y形成的化合物固态时为分子晶体
D . X与碳形成的化合物为分子晶体
在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的  洲际战略导弹是我国大国地位、国防实力的显著标志.其制作材料中包含了
洲际战略导弹是我国大国地位、国防实力的显著标志.其制作材料中包含了  、
、  、
、 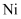 、C等多种元素。请回答:
、C等多种元素。请回答:
 洲际战略导弹是我国大国地位、国防实力的显著标志.其制作材料中包含了
洲际战略导弹是我国大国地位、国防实力的显著标志.其制作材料中包含了  、
、  、
、 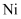 、C等多种元素。请回答:
、C等多种元素。请回答:
-
(1) 铁位于元素周期表中列,基态
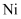 的核外简化电子排布式为。
的核外简化电子排布式为。
-
(2)
 常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测
常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测  是晶体。
是晶体。
-
(3) 实验室常用
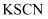 溶液检验
溶液检验  。
。 ①与
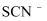 互为等电子体的非极性分子的化学式为。
互为等电子体的非极性分子的化学式为。②
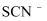 中碳原子杂化类型为。
中碳原子杂化类型为。 -
(4) 配位化合物
 中心原子
中心原子  的配位数为,配位原子为。
的配位数为,配位原子为。  中含
中含  键
键  。
。
-
(5) 已知
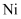 可以形成多种氧化物,其中一种
可以形成多种氧化物,其中一种  晶体的晶胞结构为
晶体的晶胞结构为  型(
型(  晶胞如下图),由于晶体缺陷导致
晶胞如下图),由于晶体缺陷导致  ,晶胞参数为
,晶胞参数为  ,则晶体密度为
,则晶体密度为 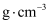 (
(  表示阿伏加德罗常数的值,只需列出计算式)。
表示阿伏加德罗常数的值,只需列出计算式)。 
回答下列问题:
-
(1) A元素的原子的价电子排布为3s23p2 , B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子,E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
①C的元素符号为,化合物AB2形成的晶体属晶体。
②A、C、D三种元素的第一电离能由大到小的顺序是(用元素符号表示)
③E的元素符号为,其基态原子的价层电子排布式为。
-
(2) 某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是:

①K和Sb原子数之比为;
②与Sb最邻近的K原子数为个;与Sb最邻近的Sb原子数为个;
③该合金的密度为(只要求列出算式)。
在高温超导领域,有一类化合物是钙钛矿型材料,此类化合物中最早被发现的是钛酸钙,其晶胞结构如图所示。试回答下列问题:

-
(1) 基态Ti原子的核外电子排布式为。
-
(2) Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是。
化合物
TiF4
TiCl4
TiBr4
TiI4
熔点/℃
377
-24.12
38.3
155
-
(3) 该钙钛矿的化学式为,其组成元素的电负性由大到小的顺序是;金属离子与氧离子间的作用力为,该晶体中每个氧离子周围与它最近且距离相等的氧离子有个。若晶胞参数为a pm,则晶体密度为g·cm-3(列出计算式,用NA表示阿伏加德罗常数的值)。
我国科学家研究发现,在KOH催化下,CO(NH2)2和LiTPSI还原形成稳定的LiF/高分子双层SEI,使LiMn2O4//Li4T15O12电池稳定工作。请回答下列问题:
-
(1) 基态Mn2+的电子排布式为[Ar]。基态K原子核外电子云轮廓图呈球形的能级上占据的电子总数为。
-
(2) Mn的第三电离能大于Fe的第三电离能的主要原因是。
-
(3) CO(NH2)2中元素电负性由大到小的顺序为(用元素符号表示)。CO(NH2)2分子中碳原子的杂化方式为。
-
(4) 几种钛的卤化物的熔点如表所示:
卤化物
TiF4
TiCl4
TiBr4
TiI4
熔点/℃
377
-25
39
150
钛的卤化物熔点呈上述变化的主要原因是。
-
(5) 一种钛的氧化物晶胞如图1所示,其化学式为。

-
(6) 由钾、镍、氟组成的一种晶体结构如图2所示,该晶体密度为g·cm-3(只列计算式即可)。

工业上用焦炭还原石英砂制得含有少量杂质的粗硅,将粗硅通过化学方法进一步提纯,可以得到高纯硅。回答下列问题:
-
(1) 石英砂制粗硅的化学方程式为。
-
(2) 处于一定空间运动状态的电子在原子核外出现的概率密度分布可用形象化描述。在基态14C原子中,核外存在对自旋相反的电子。
-
(3) 碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示。
 (金刚石晶体)
(金刚石晶体) (石墨烯晶体)
(石墨烯晶体)①在石墨烯晶体中,每个六元环占有个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接个六元环。
③写出金刚石的硬度大于晶体硅的原因:。
-
(4) SiO2的晶体类型是晶体,一种SiO2晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链如下图所示。其中Si原子的杂化轨道类型是。
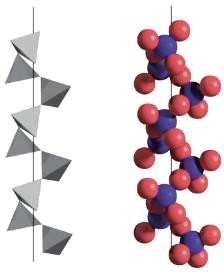
-
(5) 写出SiCl4的电子式:,H2还原气态SiCl4可制得纯硅,1100℃时每生成0.56kg纯硅需吸收akJ热量,写出该反应的热化学方程式:。
下列关于晶体的说法正确的是( )
A . 圆形容器中结出的冰是圆形的,体现了晶体的自范性
B . 石英玻璃和水晶都是晶体
C . 晶胞是晶体中最小的平行六面体
D . 液晶不是晶体,却可以表现出类似晶体的各相异性
W、X、Y、Z为原子序数依次增大的四种元素, 和
和 具有相同的电子层结构;Y的原子核外电子总数是最外层电子数的3倍;Z元素的原子M层电子全排满,3d轨道电子数比s轨道电子总数多3。回答下列问题:
具有相同的电子层结构;Y的原子核外电子总数是最外层电子数的3倍;Z元素的原子M层电子全排满,3d轨道电子数比s轨道电子总数多3。回答下列问题:
 和
和 具有相同的电子层结构;Y的原子核外电子总数是最外层电子数的3倍;Z元素的原子M层电子全排满,3d轨道电子数比s轨道电子总数多3。回答下列问题:
具有相同的电子层结构;Y的原子核外电子总数是最外层电子数的3倍;Z元素的原子M层电子全排满,3d轨道电子数比s轨道电子总数多3。回答下列问题:
-
(1) 四种元素中电负性最大的是(填元素符号),其中Y原子的核外电子排布式为。
-
(2) 单质
 和
和 互为同素异形体,其中沸点较高的是(填分子式),原因是。W和X的氢化物所属的晶体类型分别为和。
互为同素异形体,其中沸点较高的是(填分子式),原因是。W和X的氢化物所属的晶体类型分别为和。
-
(3) W和Z形成的一种化合物的晶体结构如图,该化合物中Z元素的化合价为。

-
(4) W和X能够形成化合物F,其晶胞结构如图所示,晶胞参数
 , F的化学式为;晶胞中W离子的配位数为;晶体F的密度为
, F的化学式为;晶胞中W离子的配位数为;晶体F的密度为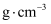 (
( 表示阿伏加德罗常数的值,列出表达式)。
表示阿伏加德罗常数的值,列出表达式)。
最近更新



