晶体的类型与物质的性质的相互关系及应用 知识点题库
①Al2O3是两性氧化物 ②硬度很大 ③它的熔点为2045℃ ④几乎不溶于水 ⑤自然界中的刚玉有红宝石和蓝宝石
①基态Fe3+的M层电子排布式为 .
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= . Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型);
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 .已知该晶胞的密度为ρ g/cm3 , 阿伏加德罗常数为NA , 求晶胞边长a= cm.(用含ρ、NA的计算式表示)
(3)下列有关的说法正确的是 .
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为
②化合物ZX3的沸点比化合物YX4的高,其主要原因是 .
③元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 .



石英玻璃的结构模型

回答下列问题:
-
(1) 金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为。
-
(2) 金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为、。
-
(3) C60属于晶体,石墨属于晶体。
-
(4) 石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的共价键.而石墨层内的C-C间不仅存在共价键,还有键。
-
(5) 金刚石晶胞含有个碳原子。若碳原子半径为r,金刚石晶胞的边长为a , 根据硬球接触模型,则r =a。
 2AlN + 3CO
2AlN + 3CO
-
(1) 氮化铝的晶体类型为。
-
(2) 制取氮化铝要用较为纯净的N2 , N2的电子式为。实验室中制备少量氮气的基本原理是:NH4Cl + NaNO2 =NaCl + 2H2O + N2↑。为了得到较纯净的N2 , 最好的收集方法是。
-
(3) 氮化铝抗酸能力极强,但抗碱蚀能力差,它能与氢氧化钠溶液反应生成NaAlO2和能使湿润红色石蕊试纸变蓝的气体,其化学反应方程式为:
-
(4) 工业上制得的AlN中含有Al2O3、C杂质,取含杂质的粗氮化铝10.00g于某容器,加入足量浓硫酸,加热,收集到672mL气体(已折算成标准状况)。则该粗氮化铝中碳的质量分数为
AlCl3 | SiCl4 | 晶体硼 | 金刚石 | 晶体硅 | |
熔点/℃ | 190 | -68 | 2 300 | >3 550 | 1 410 |
沸点/℃ | 178 | 57 | 2 550 | 4 827 | 2 355 |
-
(1) 碳化硅(SiC)是一种晶体,具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。下列各种晶体:①晶体硅 ②硝酸钾 ③金刚石 ④碳化硅 ⑤干冰 ⑥冰,它们的熔点由高到低的顺序是(填序号)。
-
(2) 下列离子晶体的立体构型示意图,如下图所示。

以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.,B:,C:,D:。
-
(3) 已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是g·cm-3。
 TiCl4↑+TiCl2 , 回答下列问题:
TiCl4↑+TiCl2 , 回答下列问题:
-
(1) 基态钛原子的价电子排布式为。与钛同周期的第ⅡB族和ⅢA族两种元素中第一电离能较大的是(写元素符号),原因是。
-
(2) 钛的氯化物的部分物理性质如下表:
氯化物
熔点/℃
沸点/℃
溶解性
TiCl4
-24
136
可溶于非极性的甲苯和氯代烃
TiCl2
1035
1500
不溶于氯仿、乙醚
①TiCl4与TiCl2的晶体类型分别是、。
②TiCl4与
 互为等电子体,因为它们相同;
互为等电子体,因为它们相同;  中心原子的杂化方式是。
中心原子的杂化方式是。 -
(3) Ti的配合物有多种。
 的配体所含原子中电负性最小的是;
的配体所含原子中电负性最小的是;  的球棍结构如图Ⅰ,Ti的配位数是。
的球棍结构如图Ⅰ,Ti的配位数是。 
-
(4) 钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图Ⅱ。
①设NA为阿伏加德罗常数的值,计算一个晶胞的质量为g。
②假设O2-采用面心立方最密堆积,Ti4+与O2-相切,则
 。
。
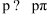 键
键
-
(1) 钛在周期表中的位置, 钛原子核外有种空间运动状态不同的电子, Ti2+电子占据的最高能层的电子排布式为。
-
(2) 已知钛和铝的相对原子半径分别是1. 45和1.43 ,钛的硬度比铝大的原因是。
-
(3) 硫酸氧钛晶体中的阳离子为链状聚合形式的离子,结构如图1所示,该阳离子的化学符号为, 该晶体中阴离子的空间构型为。

-
(4) Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为,B原子的杂化方式是,其中的BH
 可由BH3和H-结合而成。BH
可由BH3和H-结合而成。BH  含有 (填序号)
含有 (填序号) ①σ键 ②π键 ③氢键 ④配位健 ⑤离子键
-
(5) 单质钛晶体的晶胞结构如图2所示,则钛的这种堆积方式称为, 若钛原子半径为r pm,NA表示阿伏加德罗常数的值,金属钛的密度为g/cm3(列出计算式即可)




