化学综合计算 知识点题库
石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。请回答下列问题:
-
(1) COS的电子式是。
-
(2) 已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362 kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为。
-
(3) 可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3 , 该反应的平衡常数为。(已知H2CO3 的Ka1=4.2×10-7 , Ka2=5.6×10-11;H2S的Ka1=5.6×10-8 , Ka2=1.2×10-15)
-
(4) 在强酸溶液中用H2O2 可将COS氧化为硫酸,这一原理可用于COS 的脱硫。该反应反应的化学方程式为。
-
(5) COS的水解反应为COS(g)+H2O(g)
 CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示: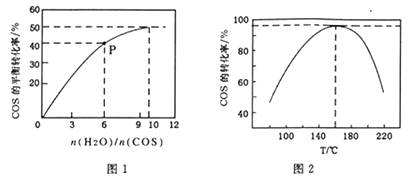
①该反应的最佳条件为:投料比[n(H2O)/n(COS)],温度
②P点对应的平衡常数为 。(保留小数点后2 位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是。
200 ml Fe2(SO4)3溶液中含Fe3+ 56g,溶液中SO42—的物质的量浓度是( )
A . 5mol/L
B . 7.5 mol/L
C . 10 mol/L
D . 2.5 mol/L
下列说法正确的是(NA为阿伏加德罗常数的值)( )
A . 在常温常压下,11.2 L N2含有的分子数为0.5NA
B . 标准状况下,22.4 L H2和O2的混合物所含分子数为NA
C . 标准状况下,18 g H2O的体积是22.4 L
D . 1 mol SO2的体积是22.4 L
已知使36g焦炭发生不完全燃烧,所得气体中CO占 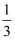 体积,CO2占
体积,CO2占 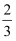 体积,已知:C(s)+
体积,已知:C(s)+  O2(g)=CO(g)△H=-Q1kJ/mol,CO(g)+
O2(g)=CO(g)△H=-Q1kJ/mol,CO(g)+  O2(g)=CO2(g)△H=-Q2kJ/mol,与这些焦炭完全燃烧相比较,损失的热量是中正确的是()
O2(g)=CO2(g)△H=-Q2kJ/mol,与这些焦炭完全燃烧相比较,损失的热量是中正确的是()
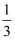 体积,CO2占
体积,CO2占 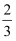 体积,已知:C(s)+
体积,已知:C(s)+  O2(g)=CO(g)△H=-Q1kJ/mol,CO(g)+
O2(g)=CO(g)△H=-Q1kJ/mol,CO(g)+  O2(g)=CO2(g)△H=-Q2kJ/mol,与这些焦炭完全燃烧相比较,损失的热量是中正确的是()
O2(g)=CO2(g)△H=-Q2kJ/mol,与这些焦炭完全燃烧相比较,损失的热量是中正确的是()
A . 2Q2kJ
B . Q2kJ
C . 3(Q1+Q2)kJ
D . 3Q1KJ
NA为阿伏加德罗常数的值。下列叙述正确的是( )
A . 1 mol Na2O2晶体中共含有4NA个离子
B . 标准状况下,22.4LCH3OH含有NA个分子
C . 常温下,1LpH=1的H2SO4溶液中,含有0.2NA个H+
D . 标准状况下,22.4LN2和O2的混合气体中含有的原子数为2NA
224mL某气体在标准状况下的质量为0.32g,该气体的摩尔质量约为( )
A . 32g·mol-1
B . 32
C . 64g·mol-1
D . 64
在两个容积相同的容器中,一个盛有NH3气体,另一个盛有H2和O2的混合气体。在同温同压下,两容器内的气体不可能具有相同的( )
A . 原子数
B . 分子数
C . 质量
D . 电子数
硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水,反应中氧化产物和还原产物的物质的量之比是( )
A . 1:1
B . 1:3
C . 2:3
D . 3:1
取 30.8g 甲酸铜[(HCOO)2Cu]在隔绝空气的条件下加热分解,会生成含两种红色固体的混合物 A 和混合气体 B;若相同质量的甲酸铜在空气中充分加热,则生成黑色固体 D 和 CO2、H2O。固体 A 和 D 质量相差 2.4g。则:
-
(1) 红色固体 A 中 Cu 单质的物质的量为mol。
-
(2) 将混合气体B 置于O2 中充分燃烧,消耗 O2 的体积是L (换算为标准状况)。
自然界中的矿石在一定的条件下可以相互转化,当蓝钒遇到硫铁矿时可转化为辉铜矿,有关反应原理可表示为:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。下列对该反应的分析错误的是( )
A . CuSO4是氧化剂,Cu2S是还原产物
B . 反应中共有2种元素化合价发生变化
C . 被氧化的FeS2与被还原的FeS2物质的量之比为2:1
D . 每生成1 mol Cu2S,共转移3 mol电子
在复杂的体系中,确认化学反应先后顺序有利于解决问题。下列化学反应先后顺序判断正确的是( )
A . 在含有等物质的量的AlO2-、OH-、CO32-溶液中逐滴加入盐酸: OH-、CO32-、AlO2-
B . 在含等物质的量的FeBr2、FeI2溶液中缓慢通入氯气: I-、Br-、Fe2+
C . Fe(NO3)3、Cu(NO3)2、HNO3混合溶液中逐渐加入铁粉: Fe(NO3)3、HNO3、Cu(NO3)2
D . 在含等物质的量的Fe3+、NH4+、H+溶液中逐滴加入NaOH溶液: H+、Fe3+、NH4+
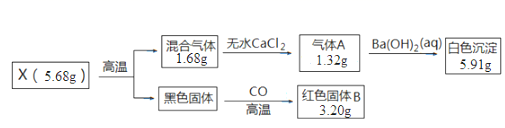
取一定量的CuCl2产品投入Na2CO3溶液中,充分反应后得到一种仅含四种元素的不溶性盐X,并产生气体CO2。设计如下实验探究X的组成和性质。已知各步反应所需试剂均过量,请回答:
-
(1) 混合气体的成分是。
-
(2) X的化学式为。
-
(3) 写出CuCl2与Na2CO3反应生成X的离子方程式。
设NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A . pH=1的H2SO4溶液,含H+的数目为NA
B . 78 g苯含有碳碳双键的数目为3NA
C . 11.2L(标准状况)正戊烷含有的分子数目为0.5NA
D . 1 mol CH3COONa溶于稀醋酸,溶液呈中性时含CH3COO-数目为NA
化学反应在发生物质变化的同时伴随有能量的变化,是人类获取能量的重要途径,而许多能量的利用与化学反应中的能量变化密切相关。
-
(1) I. H2+Cl2=2HCl的反应过程如图所示:
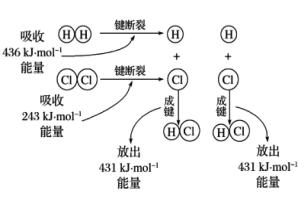
①根据如图填写下表:
化学键
断裂或形成1mol化学键时能量变化
反应中能量变化
Cl-Cl
吸收243kJ
共吸收679kJ
H-H
吸收436kJ
H-Cl
放出431kJ
共放出kJ
②该反应为反应(填“放热”或“吸热”)。
-
(2) 硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
粗硅冶炼:(a)SiO2+2C
 Si+2CO↑;
Si+2CO↑;精炼硅:(b)Si+3HCl
 SiHCl3+H2;
SiHCl3+H2;(c)SiHCl3+H2
 Si+3HCl
Si+3HCl化学反应与能量变化如图所示,回答下列问题:
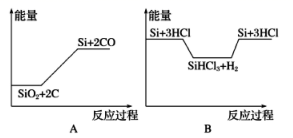
①(a)是反应,(b)是反应;(c)是反应(填“吸热"或“放热”)。
②反应(b)破坏反应物中的化学键所吸收的能量(填“大于”或“小于”)形成生成物中化学键所放出的能量。
-
(3) II.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
①该电池的负极材料是,电解质溶液是。
②正极上出现的现象是。
③若导线上转移电子1mol,则生成银g。
设  代表阿伏加德罗常数的值。下列叙述错误的是( )
代表阿伏加德罗常数的值。下列叙述错误的是( )
 代表阿伏加德罗常数的值。下列叙述错误的是( )
代表阿伏加德罗常数的值。下列叙述错误的是( )
A . 12g石墨烯和12g金刚石均含有  个原子
B . 28g氮气与6g氢气充分反应,生成的氨气分子总数为2
个原子
B . 28g氮气与6g氢气充分反应,生成的氨气分子总数为2  C . 0.1mol乙醇中含有共价键的数目为0.8
C . 0.1mol乙醇中含有共价键的数目为0.8  D . 常温常压下,
D . 常温常压下,  晶体中含有阳离子总数为0.1
晶体中含有阳离子总数为0.1 
 个原子
B . 28g氮气与6g氢气充分反应,生成的氨气分子总数为2
个原子
B . 28g氮气与6g氢气充分反应,生成的氨气分子总数为2  C . 0.1mol乙醇中含有共价键的数目为0.8
C . 0.1mol乙醇中含有共价键的数目为0.8  D . 常温常压下,
D . 常温常压下,  晶体中含有阳离子总数为0.1
晶体中含有阳离子总数为0.1 
已知:还原性:HSO  >I- , 氧化性:IO
>I- , 氧化性:IO  >I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法错误的是( )
>I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法错误的是( )
 >I- , 氧化性:IO
>I- , 氧化性:IO  >I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法错误的是( )
>I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法错误的是( ) 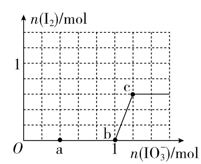
A . O~a间发生反应:3HSO  +IO
+IO  =3SO
=3SO  +I-+3H+
B . a~b间共消耗NaHSO3的物质的量为1.8mol
C . b~c间反应:I2仅是氧化产物
D . 当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.1mol
+I-+3H+
B . a~b间共消耗NaHSO3的物质的量为1.8mol
C . b~c间反应:I2仅是氧化产物
D . 当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.1mol
 +IO
+IO  =3SO
=3SO  +I-+3H+
B . a~b间共消耗NaHSO3的物质的量为1.8mol
C . b~c间反应:I2仅是氧化产物
D . 当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.1mol
+I-+3H+
B . a~b间共消耗NaHSO3的物质的量为1.8mol
C . b~c间反应:I2仅是氧化产物
D . 当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.1mol
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A . 标准状况下, 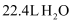 含有的分子数为NA
B . 常温常压下,质量为32 g的O2和O3混合气体中含有氧原子数为2NA
C . 20℃,101 kPa,NA个CO2分子的体积为22.4 L
D . 物质的量浓度为0.5 mol/L的MgCl2溶液中,Cl-含有个数为NA
含有的分子数为NA
B . 常温常压下,质量为32 g的O2和O3混合气体中含有氧原子数为2NA
C . 20℃,101 kPa,NA个CO2分子的体积为22.4 L
D . 物质的量浓度为0.5 mol/L的MgCl2溶液中,Cl-含有个数为NA
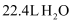 含有的分子数为NA
B . 常温常压下,质量为32 g的O2和O3混合气体中含有氧原子数为2NA
C . 20℃,101 kPa,NA个CO2分子的体积为22.4 L
D . 物质的量浓度为0.5 mol/L的MgCl2溶液中,Cl-含有个数为NA
含有的分子数为NA
B . 常温常压下,质量为32 g的O2和O3混合气体中含有氧原子数为2NA
C . 20℃,101 kPa,NA个CO2分子的体积为22.4 L
D . 物质的量浓度为0.5 mol/L的MgCl2溶液中,Cl-含有个数为NA
以下方法常用于对废水中的苯酚进行定量测定:取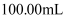 含苯酚废水,加过量溴水使苯酚完全反应,煮沸,再加入过量
含苯酚废水,加过量溴水使苯酚完全反应,煮沸,再加入过量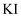 溶液生成三溴苯酚,再用
溶液生成三溴苯酚,再用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液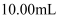 . 已知
. 已知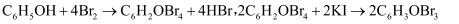 (三溴苯酚)
(三溴苯酚)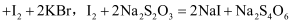 .
.  和
和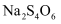 溶液颜色均为无色.
溶液颜色均为无色.
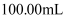 含苯酚废水,加过量溴水使苯酚完全反应,煮沸,再加入过量
含苯酚废水,加过量溴水使苯酚完全反应,煮沸,再加入过量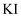 溶液生成三溴苯酚,再用
溶液生成三溴苯酚,再用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液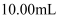 . 已知
. 已知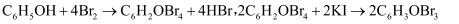 (三溴苯酚)
(三溴苯酚)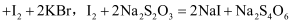 .
.  和
和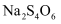 溶液颜色均为无色.
溶液颜色均为无色.
-
(1) 消耗
 的物质的量为.
的物质的量为.
-
(2) 废水中苯酚的物质的量浓度为(写出简要计算过程).
F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O→2XeO3+4Xe↑+24HF+3O2↑。下列推测正确的是( )

A . XeF2分子中各原子均达到八电子结构
B . 某种氟化氙的晶体结构单元如图,可推知其化学式为XeF6
C . XeF4按已知方式水解,每生成4molXe,转移16mol电子
D . XeF2的中心原子外层价电子对数为5
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 100g18%的葡萄糖溶液中含有的氢原子数目为1.2NA
B . 室温下,1LpH=3的NaHC2O4溶液中水电离出的OH-数目为10-11NA
C . 标准状况下,11.2LO2和O3的混合气体中含有的原子数目为NA
D . 1molCl2与消石灰完全反应制得的漂白粉中含有的钙离子数目为0.5NA
最近更新



