化学综合计算 知识点题库
0.1mol/L Al2(SO4)3溶液,Al3+物质的量浓度为mol/L,SO42﹣物质的量浓度为.
将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
下列说法正确的是( )
A . 表中V=7.84 L
B . 原混合物粉末的质量为25.6 g
C . 原混合物粉未中铁和铜的物质的量之比为2:3
D . 实验3所得溶液中硝酸的物质的量浓度为0.875 mol•L﹣1
已知:将Cl2通入适量KOH溶液,若氯气与KOH恰好完全反应,产物中可能有KCl、KClO、KClO3 , 且c(Cl-)/c(ClO-)的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
A . 若某温度下,反应后c(Cl-)/c(ClO-)=11,则溶液中c(ClO-)/ c(ClO3-)=2: 1
B . 参加反应的氯气的物质的量等于a/2 mol
C . 改变温度,反应中转移电子的物质的量ne的范围:a/2mol≤ne≤5a/6 mol
D . 改变温度,产物中KClO3的最大理论产量为a/7mol
已知:在同温同压下,相同体积的任何气体所含的分子数目都相同;常温下二氧化硫气体和硫化氢气体混合,发生反应生成硫和水。现将常温常压下 m 个二氧化硫分子和 n 个硫化氢分子混 合,若充分反应后气体的体积是反应前的一半,则 m 与 n 的比值是( )
A . 1:5
B . 1:3
C . 1:2
D . 1:1
向体积相同的甲、乙两容器中分别通入一定量的CO2和N2O,下列说法错误的是( )
A . 标准状况下,当两容器气体密度相同,则气体的物质的量相同
B . 向甲容器中通入一定的N2 , 使得两容器中氮原子数和氧原子数均相同,此时甲、乙两容器在同温下的压强之比为2:3
C . 将两气体混合,混合气体的平均摩尔质量为44g/mol
D . 同温同压下,两容器中气体质量相同
用NA表示阿伏加德罗常数,下列说法错误的是( )
A . 1L 1mol/L NaCl溶液中含有钠离子的个数为NA
B . 在标准状况下,NA个水分子所占有的体积约为22.4L
C . 7.8g Na2O2中含有阴离子的数目为0.1NA
D . 0.1molCl2与足量的氢氧化钠溶液反应时,转移电子的数目为0.1NA
某物质的分子组成为CxHyOz , 取该物质mg在足量的O2中充分燃烧后,将产物全部通入过量的Na2O2中,若Na2O2固体的质量也增加mg,则该物质分子组成中必须满足( )
A . x=y=z
B . x=y
C . y=z
D . x=z
阿司匹林的结构简式如右图: 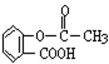
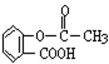
根据这一信息,回答下列问题:。
-
(1) 写出阿司匹林的分子式:
-
(2) 根据结构,推测阿司匹林的性质,下列试剂中,不能与阿司匹林反应的是(_______)A . 氢氧化钠溶液 B . 硫酸钠溶液 C . 碳酸钠溶液 D . 稀硫酸
-
(3) 阿司匹林是一种人工合成药物,化学上用水杨酸与乙酸酐(CH3CO)2O反应来制取阿司匹林。请用化学反应方程式表示这个过程:
-
(4) 阿司匹林与NaOH反应可以得到可溶性钠盐,有比阿司匹林更好的疗效。请写出此反应的方程式:
-
(5) 有四种常见药物 ①阿司匹林 ②青霉素 ③胃舒平 ④麻黄碱。请回答:
①某同学胃酸过多,应选用的药物是(填序号)。
抗酸药是治疗胃酸过多的一类药品,请写出一种抗酸药与胃酸反应的化学方程式:
②由于具有兴奋作用,国际奥委会严禁运动员服用的药物是(填序号)。
③从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是(填序号)。
④滥用药物会导致不良后果,如过量服用(填序号)会出现水杨酸中毒,应立即停药,并静脉注射NaHCO3
在酸性条件下,向含铬废水中加入FeSO4 , 可将有害的Cr2O72-转化为Cr3+ , 然后再加入熟石灰调节溶液的pH,使Cr3+转化为Cr(OH)3沉淀,而从废水中除去。下列说法正确的是( )。
A . FeSO4在反应中作氧化剂
B . 随着反应的进行,该废水的pH会减小
C . 若该反应转移0.6mol e- , 则会有0.2 mol Cr2O72-被还原
D . 除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应
下列能表示阿伏加德罗常数数值的是( )
A . 1 mol金属铝含有的电子数为3NA
B . 标准状况下,22.4 L乙醇所含的分子数为NA
C . 标准状况下,0.5 mol H2所含有的原子数为NA
D . 1 L 1 mol/L的硫酸溶液中所含的H+为NA
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
-
(1) 实验室制氯气的化学方程式:,此反应的氧化剂为: ;还原剂为:;氧化剂与还原剂物质的量之比为:;
-
(2) 工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式,并画出双线桥,标出电子转移的方向和数目:。
-
(3) 漂白粉的有效成分是(填化学式)。
已知amol H2和bmol H2O中所含的原子个数相等,则a∶b的值为( )
A . 1∶1
B . 1∶3
C . 3∶2
D . 任意比
向50 mL 18 mol·L-1的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量:( )
A . 等于0.9 mol
B . 小于0.45 mol
C . 等于0.45 mol
D . 大于0.45 mol
设  为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A . 3.0g甲醛和乙酸的混合物中所含的原子数为  B .
B . 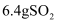 与
与 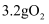 充分反应,转移的电子数为
充分反应,转移的电子数为  C .
C . 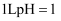 的稀硫酸中含有的氢离子数目为
的稀硫酸中含有的氢离子数目为  D . 4.6g有机物
D . 4.6g有机物  的分子结构中碳氢键数目一定为
的分子结构中碳氢键数目一定为 
 B .
B . 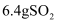 与
与 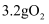 充分反应,转移的电子数为
充分反应,转移的电子数为  C .
C . 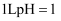 的稀硫酸中含有的氢离子数目为
的稀硫酸中含有的氢离子数目为  D . 4.6g有机物
D . 4.6g有机物  的分子结构中碳氢键数目一定为
的分子结构中碳氢键数目一定为 
在一定温度和压强下,2体积X2气体与3体积Y2气体恰好完全反应,生成2体积气体化合物Z,则Z的化学式可能是( )
A . X2Y3
B . XY
C . X3Y
D . XY3
某芳香族化合物A(相对分子质量为134)常用于治疗室上性心动过速、心律失常。其核磁共振氢谱共有a、b、c、d、e五组峰,图示如下:
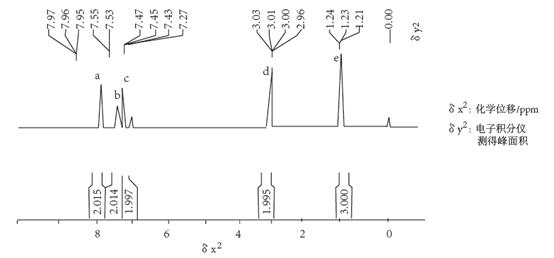
已知:①A中仅含C、H、O三种元素且不含乙基结构;
②一个碳原子同时连接羟基和氨基时该物质不稳定,易发生消去反应;N-H键比C-H键极性强,更容易断裂;
③苯环中氢的化学位移在6~8.5 ppm之间
回答下列问题:
-
(1) 可以用银氨溶液检验A中是否含有醛基,实验室配制银氨溶液的方法为。
-
(2) A的结构简式是,A与NH3加热条件下反应的化学方程式为。
-
(3) 下列A的同分异构体只含有苯环一种环状结构。
①写出存在对映异构现象的结构简式、。
②写出属于醇类且存在顺反异构的结构简式,其加聚产物的结构简式为。
设NA为阿伏加德罗常数的值.下列说法错误的是( )
A . 1L 0.1mol/L CH3COONa溶液中含有的阴离子数目为0.1NA
B . 1mol Na与足量O2充分反应后,转移的电子数目为NA
C . 常温常压下,17g H2O2含有的氧原子数目为NA
D . 11.2L(标准状况)N2与NH3的混合物中含有的共用电子对数目为1.5NA
由甲酸甲酯、葡萄糖、乙醛、乙烯四种物质组成的混合物,已知其中氧元素的质量分数为37%,则氢元素的质量分数为( )
A . 54%
B . 63%
C . 9%
D . 12%
NA代表阿伏加德罗常数的值,下列说法正确的是( )
A . 12g金刚石中含有化学键的数目为4NA
B . 7.2gCaO2中含有的阴离子数为0.2NA
C . 标准状况下,11.2L甲烷和乙烯混合气体中所含氢原子总数为2NA
D . 1mol/LMgCl2溶液中,含有Cl-的数目为2NA
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 0.1molCl2通入水中,转移电子数目0.1NA
B . 常温常压下,7.8g过氧化钠中含有阴离子的数目为0.2NA
C . 标准状况下,22.4LCl2与足量的铁充分反应,转移的电子数为3NA
D . 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
最近更新



