化学综合计算 知识点题库
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH1=−49.58 kJ·mol−1
CH3OH(g)+H2O(g) ΔH1=−49.58 kJ·mol−1
反应Ⅱ:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
反应Ⅲ:CO(g)+2H2(g) ![]() CH3OH(g) ΔH3=−90.77 kJ·mol−1
CH3OH(g) ΔH3=−90.77 kJ·mol−1
回答下列问题:
-
(1) 反应Ⅱ的ΔH2=。
-
(2) 反应Ⅲ能够自发进行的条件是(填“较低温度”、“较高温度”或“任何温度”)。
-
(3) 恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是 。A . 混合气体的密度不再变化 B . 混合气体的平均相对分子质量不再变化 C . CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1 D . 甲醇的百分含量不再变化
-
(4)
对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是______。
 A . 不同条件下反应,N点的速率最大 B . 温度低于250 ℃时,随温度升高乙烯的产率增大 C . M点时平衡常数比N点时平衡常数大 D . 实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
A . 不同条件下反应,N点的速率最大 B . 温度低于250 ℃时,随温度升高乙烯的产率增大 C . M点时平衡常数比N点时平衡常数大 D . 实际反应应尽可能在较低的温度下进行,以提高CO2的转化率 -
(5) 若在1 L密闭容器中充入 3mol H2 和1molCO2发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为;该温度下,反应的平衡常数K=;若要进一步提高甲醇的体积分数,可采取的措施有。
NA代表阿伏加德罗常数的值。下列有关叙述正确的是( )
A . 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
B . 2.3g钠被O2完全氧化时,钠得到的电子数目为0.1NA
C . 9.2g甲苯被酸性KMnO4氧化生成苯甲酸时,反应中转移电子数为0.6NA
D . 常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9NA
设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A . 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B . 常温常压下,1 mol氮气含有的核外电子数为28NA
C . 48g O2和O3的混合气体所含原子数为3NA
D . 标准状况下,11.2 L四氯化碳含有的分子数为0.5NA
下列说法中正确的是( )
A . 同温同压下,相同体积的两物质,它们的物质的量必相等
B . 任何条件下,等物质的量的氮气和一氧化碳所含的分子数必相等
C . 1L一氧化碳气体的质量一定比1L氧气的质量要小
D . 等体积、等物质的量浓度的强酸中所含的H+数一定相等
用 NA 表示阿伏加德罗常数的值,下列说法中正确的是( )
A . 1molCH4 与 Cl2 在光照条件下反应生成的 CH3Cl 分子数为 NA
B . 5.6g Fe 和 6.4g Cu 分别与足量 Cl2 反应,转移的电子数均为 0.2NA
C . 0.1mol/L 的 FeCl3 溶液中,Fe3+的数目为 0.1 NA
D . 3.0 g 葡萄糖和醋酸的混合物中含有的原子总数为 0.4 NA
如图是批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为2CH3OH+3O2=2CO2+4H2O。下列说法中错误的是( )

A . 左边的电极为电池的负极,a处通入的是甲醇
B . 每消耗3.2 g氧气转移的电子为0.4 mol
C . 电池负极的反应式为CH3OH+H2O−6e−=CO2+6H+
D . 电池的正极反应式为O2+2H2O+4e−=4OH−
已知两个热化学方程式: C(s)+O2(g) =CO2(g) ΔH=―393.5kJ/mol
2H2(g)+O2(g) =2H2O(g) ΔH=―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是( )
A . 1︰1
B . 1︰2
C . 2︰3
D . 3︰2
把
17.1g 固体氢氧化钡溶于水,配成 250mL 溶液,则该溶液的物质的量浓度是mol/L;取出 10mL溶液,其中 c(Ba2+)=mol/L;把取出的 10mL 溶液加水稀释到 100mL,稀释后溶液物质的量浓度是mol/L,其中所含溶质质量为g。
下列对于“摩尔”的理解正确的是( )
A . 摩尔是国际单位制的七个物理量之一
B . 摩尔是表示物质质量的单位
C . 科学上规定含有阿伏加德罗常数个粒子的任何粒子集合体为1mol
D . 1mol氧含6.02×1023个O2
2 mol H2O中含有质子的物质的量为( )mol
A . 20
B . 10
C . 16
D . 8
设NA表示阿伏加德罗常数,下列说法正确的是( )
A . 1mol氦气中含有2NA个氦原子
B . 14g氮气中含2NA个氮原子
C . 25℃,101 kPa下,64g SO2中含有的原子数为3NA
D . 标准状况下,11.2 L H2O含有的分子数为0.5NA
如图是某儿童在南宁市医疗机构临床检验结果报告单的部分数据:
|
分析项目 |
检测结果 |
单位 |
参考范围 |
|
|
1 |
Zn2+ |
115.92 |
μmol/L |
66-120 |
|
2 |
Fe2+ |
6.95↓ |
mmol/L |
7.52-11.82 |
|
3 |
Ca2+ |
1.68 |
mmol/L |
1.55-2.10 |
根据上表的数据,回答下列问题。
-
(1) 报告单中“μmol/L”是(填“质量”、“体积”或“浓度”)的单位。
-
(2) 0.5L该溶液中所含Ca2+的物质的量为 mmol。
-
(3) 缺铁性贫血患者应补充Fe2+。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中体现维生素C的(填“氧化性”或“还原性”)。
-
(4) 将FeCl3饱和溶液滴入煮沸的蒸馏水中,继续加热至液体变为红褐色,得到Fe(OH)3胶体,请写出该反应的化学方程式。
某元素气态氢化物的化学式为H2X,则此元素最高价氧化物对应的水化物的化学式应是( )
A . H2XO3
B . H2XO4
C . H3XO4
D . HXO4
工业上用铝土矿(主要成分是 Al2O3 , 还含有 Fe2O3、SiO2)提取氧化铝做冶 炼铝的原料(纯净的 Al2O3),某研究性学习小组设计了如下提取流程:

请回答下列问题:
-
(1) 操作①的名称是,操作③用到的仪器有酒精灯、三脚架、泥三角。
-
(2) 固体②的颜色为。
-
(3) 流程④中生成 Al(OH)3 的离子方程式是。
-
(4) 上述流程不涉及的化学反应类型是___________。A . 复分解反应 B . 氧化还原反应 C . 化合反应 D . 分解反应
-
(5) 用固体①制备硅酸,涉及的化学反应方程式为、。
-
(6) 有一种含铁、硅等元素的矿石,其主要成分的化学式为 Na2Fe5(OH)2Si8O22 , 该物质中+2 价铁与+3 价铁的物质的量之比为。将mg该矿石用足量的酸溶解后,加入过量铜粉使溶液中的铁元素全部变为 Fe2+ , 过滤后滤液用 c mol/L 的 KMnO4 酸性溶液与Fe2+反应,用去VmL溶液。该矿石中铁元素的质量分数为(用含 m、c、V 的代数式表示)。
世界某著名学术刊物介绍了一种新型中温全瓷铁-空气电池,其结构如图所示。下列有关该电池放电时的说法正确的是( )
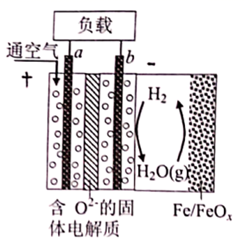
A . a极为原电池的负极
B . 正极的电极反应式为 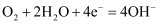 C . 放电时电子从b极经固体电解质流向a极
D . 消耗掉
C . 放电时电子从b极经固体电解质流向a极
D . 消耗掉 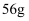 铁时,理论上要消耗
铁时,理论上要消耗 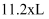 标准状况的
标准状况的 
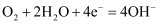 C . 放电时电子从b极经固体电解质流向a极
D . 消耗掉
C . 放电时电子从b极经固体电解质流向a极
D . 消耗掉 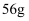 铁时,理论上要消耗
铁时,理论上要消耗 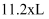 标准状况的
标准状况的 
 是一种高效多功能水处理剂,应用前景十分看好。一种制备
是一种高效多功能水处理剂,应用前景十分看好。一种制备  的原理是:
的原理是:  ,有关该反应说法错误的是( )
,有关该反应说法错误的是( )
A .  中
中  的化合价为
的化合价为 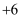 B .
B .  的氧化性强于
的氧化性强于  C . 保存
C . 保存 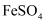 溶液时需加入少量铁粉
D . 每生成
溶液时需加入少量铁粉
D . 每生成  需要转移
需要转移  电子
电子
 中
中  的化合价为
的化合价为 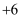 B .
B .  的氧化性强于
的氧化性强于  C . 保存
C . 保存 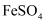 溶液时需加入少量铁粉
D . 每生成
溶液时需加入少量铁粉
D . 每生成  需要转移
需要转移  电子
电子
下列用单、双线桥表示电子转移的方向和数目错误的是( )
A . 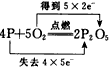 B .
B . 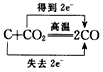 C .
C .  D .
D . 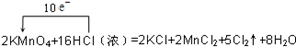
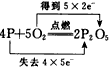 B .
B .  C .
C .  D .
D .
设NA为阿伏加德罗常数的值,下列说法错误的是( )
A . pH=2的醋酸溶液中所含H+数目为0.01NA
B . 100 mL0.1 mol/L碳酸钠溶液中所含  数目小于0.01NA
C . N2与H2混合,每有0.1 mol N2参与反应,转移的电子数为0.6NA
D . 标准状况下,2.24 LCl2完全溶于足量NaOH溶液,所得溶液中含氯微粒总数为0.2NA
数目小于0.01NA
C . N2与H2混合,每有0.1 mol N2参与反应,转移的电子数为0.6NA
D . 标准状况下,2.24 LCl2完全溶于足量NaOH溶液,所得溶液中含氯微粒总数为0.2NA
 数目小于0.01NA
C . N2与H2混合,每有0.1 mol N2参与反应,转移的电子数为0.6NA
D . 标准状况下,2.24 LCl2完全溶于足量NaOH溶液,所得溶液中含氯微粒总数为0.2NA
数目小于0.01NA
C . N2与H2混合,每有0.1 mol N2参与反应,转移的电子数为0.6NA
D . 标准状况下,2.24 LCl2完全溶于足量NaOH溶液,所得溶液中含氯微粒总数为0.2NA
等量的铝分别与100mL、2mol·L-1的盐酸与NaOH溶液反应产生氢气体积比为6:7,则反应物的量的关系为( )
A . 均恰好反应
B . 酸过量
C . 碱过量
D . 酸、碱均过量
回答下列问题:
-
(1)
 常温下是一种无色气体,可与一定量的水形成
常温下是一种无色气体,可与一定量的水形成 , 在一定条件下
, 在一定条件下 可发生如图所示转化:
可发生如图所示转化:

①H、O、B中电负性最强的元素是;基态B原子核外能量最高的电子,其电子云的轮廓图形状为。
②
 中含有的化学键为;
中含有的化学键为; 与
与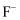 形成
形成 , 则
, 则 键的键角将变小,原因是。
键的键角将变小,原因是。 -
(2) B可以与金属
 形成
形成 、
、 、
、 等多种硼化物,金属
等多种硼化物,金属 位于周期表中的位置为,其基态原子的外围电子排布式为。
位于周期表中的位置为,其基态原子的外围电子排布式为。
-
(3) 三价B易形成
 、
、 等配离子,
等配离子, 的空间立体构型为,
的空间立体构型为, 的一种阳离子等电子体为。
的一种阳离子等电子体为。
-
(4) 以天然硼砂为原料,经过一系列反应可以制得
 :
:

请写出由
 制得
制得 的化学方程式;
的化学方程式; 有一种晶胞结构与金刚石的晶胞(如图)相似,称为立方
有一种晶胞结构与金刚石的晶胞(如图)相似,称为立方 , 可用作耐磨材料的新型无机材料。若晶胞的边长为
, 可用作耐磨材料的新型无机材料。若晶胞的边长为 , 则晶胞的密度为
, 则晶胞的密度为 (用含a、
(用含a、 的计算式表示)。
的计算式表示)。
最近更新



