化学综合计算 知识点题库
将FeO与Cu(NO3)2的混合物9.08g全部溶于300mL、1mol/L的盐酸中,有部分Fe2+被酸性条件下的NO3﹣氧化(其化学反应方程式为:3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O),放出NO气体448mL(标准状况);继续向溶液中通入一定量的Cl2恰好将溶液中的Fe2+完全氧化;再加入10g过量的铁粉,充分反应放出H2 , 过滤,得到不溶固体.下列叙述不正确的是( )
A . Cu(NO3)2的物质的量为0.01mol
B . 通入Cl2的体积(标准状况)为448mL
C . 放出H2的体积(标准状况)为112mL
D . 得到不溶固体的质量为6.72g
设NA表示阿伏加德罗常数的值,下列叙述中对应的值为 NA的是( )
A . 30 g由乙酸和乳酸组成的混合物中所含有的O原子数
B . Cu和足量的稀硝酸反应产生7.47 L NO气体时转移的电子数
C . 0.25 mol丁烷中含有的非极性键数
D . 1 mol FeCl3加入沸水制得的胶体中含有胶体粒子数
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A . 23gNa变为Na+时失去的电子数为NA
B . 18g水所含的电子数为NA
C . 8g He所含的分子数为NA
D . 16g O2与16g O3所含的原子数均是NA
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 将1mol SO2通入水中,H2SO3、HSO3-、SO32-粒子数之和为NA
B . 标准状况下,22.4L HF溶于水,溶液中HF与F-数目之和为1NA
C . 将1mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
D . 25℃时,pH=13的Ba(OH)2溶液中含有的氢氧根离子数为0.1NA
已知反应:10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2 ,下列关于该反应的叙述错误的是( )
A . 该反应中,氧化剂与还原剂物质的量之比为9:5
B . 当反应中有1mol电子转移时,被还原氯气物质的量为1/18 mol
C . 每产生1mol O2时,被氧元素还原的氯气物质的量为2mol
D . 参加反应的水有2/5被氧化
按要求回答下列各小题:
-
(1) 对于反应:NH4NO2 ═ N2↑+2H2O,NH4NO2 中 N 元素的化合价为;反应生 成 1 mol N2 , 转移的电子数的物质的量为mol。
-
(2) 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个发生还原过程的反应式: NO3-+4H++3e- → NO↑+2H2O 和发生氧化过程 KI→I2(未配平),向 KI 溶液中滴加少量稀 硝酸能使上述氧化还原过程发生,该氧化还原反应的方程式:。
-
(3) 砷及其化合物有毒,如砒霜(As2O3)有剧毒,环境监测和法医学分析砒霜中毒的反应 原理:As2O3+6Zn+6H2SO4 ═ 2AsH3↑+6ZnSO4+3H2O。
①若生成的气体在标准状况下的体积为 4.48 L,则参加反应 Zn 的质量为g。
②用双线桥法标出上述反应中电子转移的方向和数目。
一定质量的液态化合物XY2与标准状况下的一定质量的O2恰好完全反应,化学方程式为:XY2(l)+3O2(g)=XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56g/L,则:
-
(1) 反应前O2的体积是。
-
(2) 化合物XY2的摩尔质量是。
等体积的Al2(SO4)3、ZnSO4、Na2SO4溶液分别与足量BaCl2溶液反应。若生成BaSO4沉淀的质量比为1∶2∶3,则三种硫酸盐的物质的量浓度之比为( )
A . 1∶2∶3
B . 1∶6∶9
C . 1∶3∶3
D . 1∶3∶6
NA表示阿伏加德罗常数,下列叙述正确的是( )
A . 等质量的N2和CO所含分子数均为NA
B . 1 mol·L-1 NaCl溶液中含有Cl-的个数为NA
C . 常温常压下,48 g O2和48 g O3 含有的氧原子数均为3NA
D . 标准状况下,22.4 L的水中含有NA个H2O分子
以下有关物质的质量分数和物质的量浓度的叙述正确的是( )
A . 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成硫酸钡沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1:1:1
B . Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等
C . 质量分数分别为5%和15%的硫酸溶液等体积混合后,所得溶液的质量分数为大于10%
D . 20℃时,饱和KCl溶液的密度为1.174g.cm-3 , 物质的量浓度为4.0mol/L ,则此溶液中KCl的质量分数为 

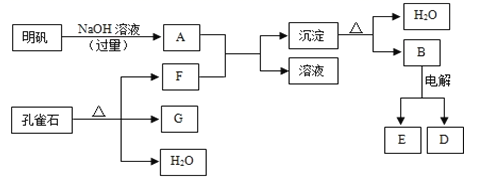
在一定条件下可实现下图所示物质之间的转化:
请填写下列空白:
-
(1) 孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是(填化学式)。
-
(2) 写出明矾溶液与过量NaOH溶液反应的离子方程式:。
-
(3) 图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式,该反应消耗了3 molG,则转移的电子数是。
某海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
| 离子 | | | | | | | |
| 含量 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

A . 甲室的电极反应式为: 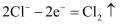 B . 乙室和丁室中部分离子的浓度增大,淡水的出口为b
C . 当戊室收集到
B . 乙室和丁室中部分离子的浓度增大,淡水的出口为b
C . 当戊室收集到 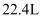 (标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
D . 淡化过程中易在戊室形成水垢
(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
D . 淡化过程中易在戊室形成水垢
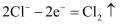 B . 乙室和丁室中部分离子的浓度增大,淡水的出口为b
C . 当戊室收集到
B . 乙室和丁室中部分离子的浓度增大,淡水的出口为b
C . 当戊室收集到 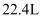 (标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
D . 淡化过程中易在戊室形成水垢
(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
D . 淡化过程中易在戊室形成水垢
质量分数为a%的NaOH溶液蒸发掉b g水后,得到V ml质量分数为2a%的NaOH溶液,则蒸发后NaOH溶液的物质的量浓度为( )
A . ab/2V mol·L-1
B . ab/2000V mol·L-1
C . 250ab/V mol·L-1
D . ab/80V mol·L-1
白磷有剧毒,被白磷污染的物品应即刻用硫酸铜溶液浸泡并清洗,反应原理是:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4下列说法正确的是( )
A . 该反应中CuSO4将白磷氧化为Cu3P
B . 该反应中1 mol CuSO4氧化0.1 mol P4
C . Cu3P既是氧化产物,又是还原产物
D . 该反应中白磷发生歧化反应,其中作氧化剂和作还原剂的P4的质量之比为5∶6
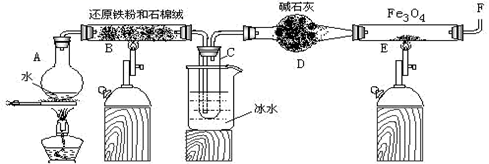
在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)
-
(1) 烧瓶A中常加入碎瓷片,其作用是,小试管C的作用是。
-
(2) 为了安全,在E管中的反应发生前,在F出口处必须,E管中的反应开始后,在F出口处应。
-
(3) 反应3Fe+4H2O(g)
 Fe3O4+4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释。
Fe3O4+4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释。
-
(4) 停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现象。
-
(5) 若E管中反应按以下两步进行:Fe3O4+H2
 3FeO+H2O,FeO+H2
3FeO+H2O,FeO+H2  Fe+H2O,假设实验开始时E管中的Fe3O4为23.2 g,反应一段时间后停止实验,冷却后取出其中固体干燥后称量,其质量变为20 g。通过计算分析其组成可能为(填序号)
Fe+H2O,假设实验开始时E管中的Fe3O4为23.2 g,反应一段时间后停止实验,冷却后取出其中固体干燥后称量,其质量变为20 g。通过计算分析其组成可能为(填序号) ①Fe ②Fe和Fe3O4 ③FeO和Fe3O4 ④Fe和FeO ⑤Fe、FeO和Fe3O4
用此20 g固体与铝粉在一定条件下进行铝热反应,最多可消耗铝粉g。(不考虑空气中的成分参与反应)
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 在过氧化钠与水的反应中,每生成0.1 mol氧气,转移的电子数目为0.2NA
B . 将含有NA个Al3+的AlCl3溶液完全蒸干,可得到1mol的固体AlCl3
C . 电解法精炼铜,当电路中有0.2NA个电子转移时,阳极的质量一定减轻6.4g
D . 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目约为0.1NA
“免加水铅蓄电池”其寿命可长达4年,放电时总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列有关判断错误的是( )

A . 充电时,a电极发生氧化反应
B . 放电时,溶液中H+向PbO2电极迁移
C . 充电时,阴极反应为PbSO4+2e-=Pb+SO  D . 放电时,当负极转移1mole-时,正极消耗1molH+
D . 放电时,当负极转移1mole-时,正极消耗1molH+
 D . 放电时,当负极转移1mole-时,正极消耗1molH+
D . 放电时,当负极转移1mole-时,正极消耗1molH+
用NA表示阿伏加德罗常数的值,下列说法错误的是( )
A . 标准状况下,11.2 L以任意比例混合的氮气和氧气中所含的原子总数为NA
B . 1 mol Na2SO4溶于水,所得溶液中Na+的数目为2NA
C . 46 g由NO2和N2O4组成的混合气体中含有的原子数为3NA
D . 2 mol·L-1的氯化镁溶液中含有的氯离子数目为4NA
工业尾气中的氯气有多种处理方法。
-
(1) 处理尾气中少量氯气的方法如图所示。

①处理过程中,发生反应的离子方程式为。
②为维持处理过程的持续进行,需要定期加入的物质是。
-
(2) 大量氯气可用NaOH溶液处理,标准状况下,处理11.2L Cl2转移电子的物质的量为mol。
将钠、铁、铝各0.5mol分别放入100mL1mol/L的盐酸中,同温同压下产生的气体的体积比为( )
A . 3:2:1
B . 5:1:1
C . 4:1:1
D . 1:1:1
最近更新