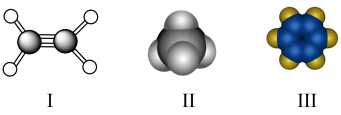
化学式及其计算 知识点题库
 L
B .
L
B .  L
C .
L
C .  L
D .
L
D .  L
L
(1)求H2R的相对分子质量;
(2)推断R元素的名称;
(3)确定R在元素周期表中的具体位置.
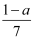 B .
B . 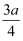 C .
C . 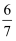 (1﹣a)
D .
(1﹣a)
D .  (1﹣a)
(1﹣a)
①该研究小组是否成功制得+1价Ca的化合物? (填“是”或“否”).甲的化学式是 .
②甲与水反应可得H2 , 其化学方程式是 .
③在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是 ;乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 .
④请写出一个你认为可能得到CaCl的化学方程式(以CaCl2为原料)
2014年3.15晚会的主题为“让消费更有尊严”,食品行业依旧是消费者最为关注的行业.频发的食品安全事件,让公众几乎患上了“食物焦虑症”.国际环保组织绿色和平发布报告,称对“立顿”的绿茶、茉莉花茶和铁观音袋泡茶检验,发现含有被国家禁止在茶叶上使用的高毒农药灭多威.灭多威是一种白色晶状固体,略具有硫磺的气味,其化学式为C5H10N2O2S.
(1)灭多威是由 种元素组成,它属于 (填“无机物”“有机物”之一).
(2)灭多威中氮元素与硫元素的质量比是 (填最简整数比).
(3)在灭多威中,所含元素质量分数最大的元素是 (填元素名称).


请回答:
-
(1) X的化学式是。
-
(2) 白色粉末溶于氢氧化钠溶液的离子方程式是。
-
(3) 高温条件下白色粉末与焦炭发生置换反应,写出该反应的化学方程式。

下列有关说法正确的是( )
 )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的
)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的  (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
-
(1) 制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有(填标号)。
A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
-
(2) 将
 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为,与直接用废铜和浓硫酸反应相比,该方法的优点是。
加入到适量的稀硫酸中,加热,其主要反应的化学方程式为,与直接用废铜和浓硫酸反应相比,该方法的优点是。
-
(3) 待
 完全反应后停止加热,边搅拌边加入适量
完全反应后停止加热,边搅拌边加入适量  ,冷却后用
,冷却后用  调
调  为3.5~4,再煮沸
为3.5~4,再煮沸 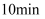 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、、乙醇洗涤、,得到胆矾。其中,控制溶液
,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、、乙醇洗涤、,得到胆矾。其中,控制溶液  为3.5~4的目的是,煮沸
为3.5~4的目的是,煮沸 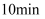 的作用是。
的作用是。
-
(4) 结晶水测定:称量干燥坩埚的质量为
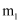 ,加入胆矾后总质量为
,加入胆矾后总质量为 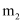 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为  。根据实验数据,胆矾分子中结晶水的个数为(写表达式)。
。根据实验数据,胆矾分子中结晶水的个数为(写表达式)。
-
(5) 下列操作中,会导致结晶水数目测定值偏高的是(填标号)。
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少胆矾迸溅出来
酸化反应:MgCl2·6NH3+6HCl=MgCl2+6NH4Cl;
碳化反应:MgCl2+2NH4HCO3=Mg(HCO3)2+2NH4Cl;
热解反应:Mg(HCO3)2→xMgCO3·yMg(OH)2·zH2O↓+CO2↑(未配平)。
下列说法正确的是( )
-
(1) 制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
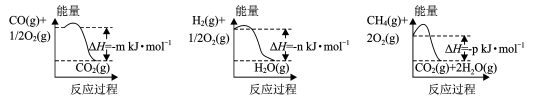
CH4 (g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式为。
-
(2) 工业乙醇也可用CO和H2合成,常含一定量甲醇,各国严禁使用成本低廉的工业酒精勾兑食用酒,但一般定性的方法很难检测出食用酒中的甲醇。有人就用硫酸酸化的橙色K2Cr2O7溶液定量测定混合物中甲醇的含量,甲醇与酸性K2Cr2O7溶液反应生成CO2、Cr2(SO4)3等物质,写出其化学方程式 。
-
(3) 为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体混合物通过足量的碱石灰,碱石灰 增重4. 08 g,又知生成CO2和H2O的物质的量之比为3:4。则M中碳、氢、氧原子个数之比为。
-
(4) CO2和H2合成甲醇涉及以下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=-49.58kJ/mol。在反应过程中可以在恒压的密闭容器中,充入一定量的CO2和H2 , 测得不同温度下,体系中CO2的平衡转化率与压强的关系曲线如图所示:
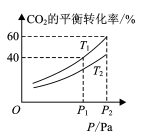
①反应过程中,表明反应达到平衡状态的标志是;
A.生成3mol O-H键,同时断裂3mol H-H键 B.容器中气体的压强不再变化
C.容器中气体的平均摩尔质量不变 D.CH3OH的浓度不再改变
②比较T1与T2的大小关系:T1 T2 (填“<”、“=”或“>”)。
③在T1和P2的条件下,向密闭容器中充入1mol CO2和3mol H2 , 该反应在第5 min时达到平衡,此时容器的容积为2.4 L,则该反应在此温度下的平衡常数为,保持T1和此时容器的容积不变,再充入1mol CO2和3mol H2 , 设达到平衡时CO2的总转化率为a,写出一个能够解出a的方程或式子 (不必化简,可以不带单位)。
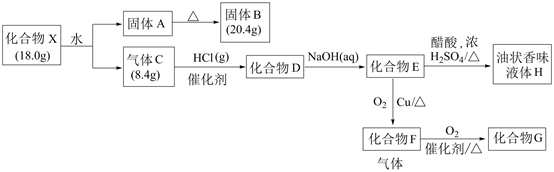
已知:①固体A既能溶于NaOH溶液又能溶于盐酸;
②气体C为纯净物;
③E摩尔质量为 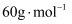 ,能与足量的钠反应生成2.24L氢气(标准状况下测定)。
,能与足量的钠反应生成2.24L氢气(标准状况下测定)。
请回答:
-
(1) 组成X的元素是;化合物D的结构简式。
-
(2) 化合物X与足量稀盐酸反应的离子方程式是。
-
(3) 写出E到F的化学方程式。
-
(4) 下列说法正确的是_______(填序号)。A . 固体B是两性氧化物,常用来制造耐火材料 B . 化合物D与浓硫酸共热可得到气体C C . 可以用新制氢氧化铜悬浊液来鉴别E、F、G D . 化合物E的同类同分异构体可以通过连续氧化反应得到羧酸
-
(5) 某同学将化合物E与醋酸反应得到的H进行提纯,在未用指示剂的情况下,先加NaOH中和过量的酸,然后用蒸馏法将H分离出来,结果得到大量水溶性物质。试分析产生上述现象的原因。
-
(1) MnSO4有多种制备方法。
①方法1:将锌精矿(主要成分为ZnS)和软锰矿(主要成分为MnO2)混合后用硫酸溶液浸出,反应的离子方程式为ZnS+MnO2+4H+=Zn2++Mn2++S+2H2O。溶液中加入Fe3+可以促进反应的发生,反应原理如图所示,其中 (填 “A”或“B”)表示Fe3+。
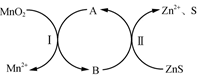
②方法2:在硫酸溶液中用铁屑还原MnO2 , 铁屑被氧化为Fe3+ , 该反应的离子方程式为。为除去MnSO4溶液中的Cd2+ , 向溶液中通入H2S气体至饱和(H2S饱和溶液的浓度为0.1 mol·L-1 , H2S的电离常数Ka1=1.5×10-7、Ka2=6×10-15),c(H+)=0.3 mol·L-1时,溶液中c(Cd2+)=mol·L-1。[Ksp(CdS)=8×10-27]
-
(2) MnSO4和(NH4)2SO4可制取硫酸铵锰晶体[(NH4)aMnb(SO4)c·xH2O],为测定该晶体的组成,进行如下实验:①称取一定质量的硫酸铵锰晶体,在空气中加热至脱去全部结晶水,质量减少30.8%;②将残留固体配成250 mL溶液A,取出25.00 mL,加入足量NaOH溶液充分加热,生成22.40 mL(标准状况)NH3;③另取25.00 mL溶液A,加入足量的BaCl2溶液得到0.233g BaSO4。通过计算确定该晶体的化学式。(写出计算过程)