化学式及其计算 知识点题库
下列各组混合物,不论以何种比例混合,只要总物质的量一定,完全燃烧后,产生的CO2的量为一个常数的是( )
A . 乙炔和甲苯
B . 甲烷和乙烷
C . 丙烯和丙烷
D . 乙烯和丁烯
已知氢元素有1H、2H、3H三种同位素,氯元素有35Cl、37Cl两种同位素.由这五种微粒构成的HCl分子中,其相对分子质量可能有( )
A . 1种
B . 5种
C . 6种
D . 7种
某物质A在一定条件下受热全部分解,产物都是气体.分解的化学方程式为2A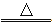 B+2C+D.测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
B+2C+D.测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
A . 7d
B . 5d
C . 4d
D . 2d
在150℃时,将一定质量的NH4HCO3放在密闭容器中分解完全.保持温度不变,求生成气体的平均相对分子质量.
已知硒酸钠中各元素的质量分数为:Na﹣a,Se﹣b,其余为氧;硫酸钠中各元素的质量分数为:Na﹣c,S﹣d,其余为氧;用以上数据测定Se元素的相对原子质量时,还需要用到的数据是( )
A . Na元素的相对原子质量
B . S元素的相对原子质量
C . O元素的相对原子质量
D . Se元素各同位素的丰度
乙烯、乙醛蒸气组成的混合物中,氢元素质量占总质量的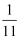 , 则氧元素的质量占总质量的( )
, 则氧元素的质量占总质量的( )
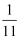 , 则氧元素的质量占总质量的( )
, 则氧元素的质量占总质量的( )
A .  B .
B . 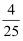 C .
C . 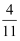 D .
D . 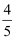
 B .
B . 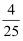 C .
C . 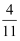 D .
D . 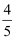
β﹣胡萝卜素(C40H56)是一种天然的植物色素,它广泛存在于黄绿色蔬菜和水果中,一定条件下在人体内它能够转化为维生素A(C20H30O).从元素组成的角度,β﹣胡萝卜素含有 种元素;维生素A中碳、氢、氧元素的质量比为 (不用化简).
下列铁的化合物中,铁的质量分数最高的是( )
A . FeS2
B . FeO
C . Fe2O3
D . Fe3O4
甲苯(C7H8)和甘油(C3H8O3)组成的混合物中,若碳元素的质量分数为60%,那么可以推断氢元素的质量分数约为( )
A . 5%
B . 8.7%
C . 17.4%
D . 无法计算
乙醇、环丙烷、1﹣丁烯三种物质组成的混合物中氧元素的质量分数为8.0%,则混合物中氢元素的质量分数为( )
A . 12.0%
B . 13.0%
C . 14.0%
D . 无法计算
固体单质A和气体单质B在容积一定的密闭容器中恰好完全反应生成气体C,相同温度下测得容器内压强不变,若产物气体C的密度是原气体密度的4倍,则判断正确的是( )
A . 单质A与B的摩尔质量之比是1∶4
B . 反应前后的气体质量之比一定是1∶4
C . 生成物C中,A的质量分数为50%
D . 生成物C中A,B两元素的原子个数比为3∶1
常温下,A、B组成的混合气体(  )经分析发现无论怎样混合,气体中仅含的C、O两种元素的质量比总小于3∶8,若混合气体中C、O质量比为1∶8,则A、B两气体的体积比可能为( )
)经分析发现无论怎样混合,气体中仅含的C、O两种元素的质量比总小于3∶8,若混合气体中C、O质量比为1∶8,则A、B两气体的体积比可能为( )
①3∶4 ②2∶1 ③4∶1 ④4∶3 ⑤1∶2
A . 只有⑤
B . ①②
C . ④⑤
D . ②④
鸡蛋壳的主要成分是碳酸钙,碳酸钙中钙的质量分数是( )
A . 25%
B . 40%
C . 50%
D . 60%
茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以检验某品牌茶叶中铁元素的存在并测定钙元素的质量分数(已知CaC2O4为白色沉淀物质)。首先取200g茶叶样品进行如图操作:

已知:①文献资料显示:某些金属离子的氢氧化物完全沉淀时的pH为:Ca(OH)2:13,Fe(OH)3:4.1
②(NH4)2C2O4溶液显酸性。
-
(1) 实验前要先将茶叶样品高温灼烧为灰粉,需要用到的实验仪器有酒精灯、三脚架、玻璃棒、泥三角,其主要目的是。
A.蒸发皿 B.坩埚C.石棉网
-
(2) 从滤液A→沉淀D的过程中需要加入的物质X可以选择________。A . CaO B . Ca(OH)2 C . NH3·H2O
-
(3) 用酸性KMnO4标准溶液滴定滤液C时发生的反应为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。将滤液C稀释至250mL,取25.00mL溶液,用硫酸酸化后,用0.10mol·L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液体积如表所示:
编号
KMnO4溶液体积/mL
1
19.98
2
22.00
3
20.02
①此步操作过程中需要用到图示中哪些仪器

②滴定达到终点时的现象是。
③为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,若不洗涤沉淀D,会使测定的钙元素的含量(偏低、偏高、无影响,下同),若不洗涤沉淀E,会使测定的钙元素的含量。
④原茶叶中钙元素的质量分数为。(用含a的代数式表示,已知(NH4)2C2O4的摩尔质量为124g·mol-1)。
-
(4) 可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是、。
TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,M=240g/mol。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。


-
(1) 写出仪器a的名称,A中的化学反应方程式:;
-
(2) B中试剂是,作用是 ;
-
(3) 装置C中CuO粉末的作用为。
-
(4) 理想状态下,将4.80 gTMB样品完全氧化,点燃C处酒精灯,实验结束时测得D增加3.60 g,E增加14.08 g,则TMB的分子式为。
-
(5) 有同学认为,用该实验装置测得的TMB分子式不准确,应在干燥管E后再添加一个装有碱石灰的干燥管F。你认为是否需要添加F装置(填“需要”或“不需要”),简述理由。
-
(1) 等质量的O2、CH4、H2的物质的量之比为,标准状况下,体积之比为,密度之比为。
-
(2) 44.4g某二价金属氯化物(ACl2)中含有0.8molCl- , 则ACl2的摩尔质量是,A的相对原子量是,ACl2的化学式是。
-
(3) 同温同压下,同体积的气体X2和气体Y2完全反应生成气体Z,且反应前后气体体积不变,则Z的化学式为。
铁铵矾常用作测定卤素的指示剂,化学式为(NH4)aFeb(SO4)c·dH2O,为测定其组成,某化学兴趣小组进行了以下实验:
I.称取144.6g样品,灼烧至恒重时(假如只失去结晶水,不发生其他反应),得蒸馏水的质量为64.8g。
II.将上述剩余固体完全溶于水,并将所得溶液分成三等份:
①往其中一份中加入足量的 NaOH 浓溶液并加热,最终得到标准状况下2.24L气体。
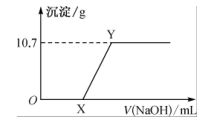
②往第二份中加入稀硫酸,然后向此混合溶液中逐滴加入0.1mol·L-1 NaOH 溶液,滴加过程中产生红褐色沉淀的质量与加入 NaOH 溶液的体积的关系如图所示:
③往第三份中加入足量的0.1mol·L-1 BaCl2溶液,生成不溶于稀硝酸的白色沉淀46.6g
回答下列问题:
-
(1) 操作①中生成气体的离子方程式为。
-
(2) 操作②中OX段反应的离子方程式为 ;XY 段反应的离子方程式为 。
-
(3) 操作③中生成的沉淀为 ,其物质的量为。
-
(4) 铁铵矾的化学式为 。
青蒿素的化学式为C15H22O5 , 下列关于青蒿素的说法正确的是( )
A . 青蒿素属于氧化物
B . 一个青蒿素分子中有11个氢分子
C . 青蒿素由42种元素构成
D . 青蒿素中碳元素的质量分数最大
把密度为1.6g/ cm3的液态S2Cl2 10mL溶于石油醚(一种溶剂), 得到100mL溶液,把它慢慢加入50 mL3.2mol/L的SO2水溶液中,振荡使之充分反应,当加入的S2Cl2溶液为67.5mL时,恰好反应完全。生成物用含0.32mol KOH的KOH溶液中和后,恰好完全转化为KCl和一种二元含氧酸的钾盐晶体。请计算
-
(1) 参与反应的n(S2Cl2): n(SO2)=1:
-
(2) 确定二元含氧酸的化学式。
某芳香族有机化合物A能与NaOH溶液反应,相对分子质量为136,其中含碳的质量分数为70.6%,氢的质量分数为5.9%,其余为氧。
-
(1) A的分子式是。
-
(2) 若A含有酯基,且1molA消耗1molNaOH,则A的结构简式可能是或。
-
(3) 若A能与
 溶液发生显色反应,也能发生银镜反应,其结构有种。
溶液发生显色反应,也能发生银镜反应,其结构有种。
-
(4) 若A分子苯环上只有一个取代基,既能发生银镜反应又能与NaOH溶液反应,写出其与NaOH溶液反应的化学方程式。
最近更新



