化学实验 知识点题库

已知:①锂电池废料的主要成分是 LiCoO2、铝、炭黑及其他杂质。
②“溶液 A”中主要金属离子是 Co2+、Li+ , 还含有少量 Fe3+、Al3+、Cu2+。
请回答:
-
(1) 步骤Ⅰ中铝溶解的离子方程式为 ;
步骤Ⅲ中 LiCoO2 固体溶解的化学方程式为 ;
-
(2) 关于步骤Ⅱ,下列实验操作或说法合理的是A . 灼烧前,灼烧使用的蒸发皿洗净后不需要擦干,然后加入固体 X 进行灼烧 B . 灼烧时需要用玻璃棒不断搅拌 C . 灼烧至恒重是指前后两次称量所得质量之差不得超过一定的允许误差,这个允许误差一定为 0.01g D . 在电解熔融的Al2O3 制备金属铝时,通常需加入冰晶石(NaAlF6)以增强其导电性
-
(3) 步骤Ⅳ中除杂时可加入氨水调节溶液的 pH,实验表明溶液A 中各种金属离子的沉淀率随 pH 的变化如右下图所示,则步骤Ⅳ中可除去的杂质离子是。

-
(4) 步骤Ⅴ可采用酸碱滴定法测定碳酸锂的纯度。滴定原理如下:碳酸锂能够与盐酸反应生成氯化锂和二氧化碳,在碳酸锂未完全反应时,溶液保持中性(pH=7)。反应完全后,随着盐酸的继续滴入,溶液PH 下降,以甲基红—溴甲粉绿为指示剂,用盐酸标准液滴定试样,用消耗盐酸标准滴定溶液的量来计算碳酸锂的含量。
①配制约 0.30mol•L﹣1 盐酸溶液不需要用到的仪器有 (填编号)
a. 量筒 b.电子天平 c. 漏斗 d. 烧杯 e. 容量瓶 f. 玻璃棒 g. 胶头滴管
②用 0.3000mol•L﹣1 盐酸标准溶液滴定,其中正确操作步骤的顺序为
a. 加入 0.1-0.2mL 甲基红—溴甲粉绿作指示剂;
b. 煮沸去除 CO2 , 再冷却到室温;
c. 将试样置于 250mL 锥形瓶中,加入 20mL 水溶解;
d. 用盐酸标准液滴定至试液由绿色变成酒红色;
e. 继续滴定至酒红色(滴定突跃区域)即为终点
③碳酸锂的纯度可用下式计算:ω=
 ×100%
×100% 其中:ω—碳酸锂试样的纯度; m—碳酸锂试样的质量(g);
c—盐酸标准液的浓度(mol•L﹣1)
V1—试样滴定时消耗盐酸的体积(mL);
V0—滴定空白溶液(指不加试样进行滴定)时标准盐酸消耗的体积(mL)0.03694—与 1.00mL 标准盐酸(c=1.000 mol•L﹣1)相当的碳酸锂的质量(g) 滴定空白溶液的目的是
上述滴定操作中,缺少“煮沸去除 CO2 , 再冷却到室温”这个步骤,测定结果将
(填“偏大”、“偏小”、“无影响”)

-
(1) 写出 A 官能团名称: ;G 的分子式: 。
-
(2) 写出 B 与D 反应生成E 的化学方程式 , 该反应需要使用浓硫酸作用是: ,E 的同分异构体中,能与 Na 反应,又能与 Na2CO3 溶液反应的物质是 (用结构简式书写一种即可)
-
(3) 物质 X 可由下图装置制备。固体药品 Z 可能为 (填一种化学式)。B 与 X 催化反应生产 C 的化学方程式为 。

-
(4) 检验 G 的水解生成了 F 的方法为
-
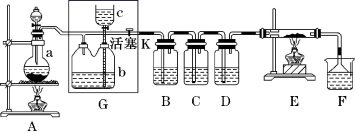
(1) 若A中烧瓶中的固体为MnO2 ,液体为浓盐酸 ,则A中发生反应的化学方程式为。
-
(2) G中b瓶内宜加入的液体是 ,怎样检验装置G的气密性。
-
(3) 实验开始后B中的现象是 ,C中的现象是。
-
(4) 装置E中硬质玻璃管内盛有炭粉 ,若E中发生氧化还原反应 ,其产物为二氧化碳和氯化氢 ,写出E中反应的化学方程式。
-
(5) 在F中 ,紫色石蕊试液的颜色由紫色变为红色 ,再变为无色,其原因是。
 溶液以除去混在
溶液以除去混在  中的少量
中的少量  B . 通过酸性
B . 通过酸性  溶液以除去混在
溶液以除去混在  中的少量乙烯
C . 往
中的少量乙烯
C . 往  溶液中加入过量的氨水制备
溶液中加入过量的氨水制备 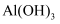 D . 将
D . 将 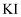 溶液滴到一片土豆上,发现马上变蓝,说明土豆含有淀粉
溶液滴到一片土豆上,发现马上变蓝,说明土豆含有淀粉
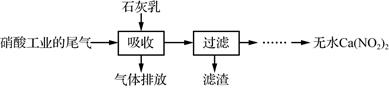
下列说法错误的是( )
 和
和  等结晶形式。某兴趣小组以废铁屑为原料制备的主要流程如下:
等结晶形式。某兴趣小组以废铁屑为原料制备的主要流程如下: 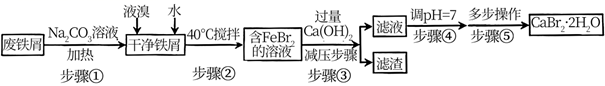 已知:34℃时结晶得到
已知:34℃时结晶得到  ,
,  加热至210℃得到
加热至210℃得到  。
。
请回答:
-
(1) 步骤①中加
 溶液是为了除去废铁屑表面的油污(主要成分为油脂),加热的目的是(用简要文字和必要的离子方程式说明)。
溶液是为了除去废铁屑表面的油污(主要成分为油脂),加热的目的是(用简要文字和必要的离子方程式说明)。
-
(2) 步骤④调
 所用的试剂应选择_______。
A .
所用的试剂应选择_______。
A . 溶液
B .
溶液
B . 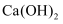 溶液
C .
溶液
C .  溶液
D .
溶液
D . 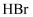 溶液
溶液
-
(3) 步骤⑤多步操作包括、、过滤、洗涤、。
-
(4) 下列有关说法错误的是_______。A . 步骤②反应控制在40℃左右的原因是防止反应过于剧烈并减少液溴挥发 B . 为充分利用铁屑,应加入稍过量的液溴使铁屑完全溶解 C . 步骤③过滤时,应用玻璃纤维代替滤纸 D . 下图装置过滤结束时可先打开止水夹a后直接关闭水龙头;
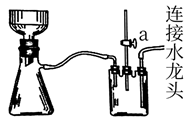
-
(5) 兴趣小组模拟海水提取溴的过程,用苯萃取稀溴水中的溴,选出其正确操作并按顺序列出字母:
涂凡士林→检漏→→→→→→清洗干净。
a.打开玻璃塞放气
b.打开旋塞放气
c.将溶液和苯转移至分液漏斗中,塞上玻璃塞
d.右手压住玻璃塞,左手握住旋塞,将分液漏斗上下颠倒振荡
e.右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转振荡
f.置于铁架台铁圈上静置,打开玻璃塞,将旋塞拧开,放出下层液体
g.从下口放出溴的苯溶液
h.从上口倒出溴的苯溶液

已知:①镍能溶于稀酸但溶解不完全,通常表现为+2价;
②常温下Ksp(MgF2)=6.4×10-9 , Ka(HF)=6.3×10-4;
-
(1) NiSO4中阴离子的空间构型为。
-
(2) “溶解”时加入H2O2溶液的目的是。
-
(3) “除铁”时生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出其离子方程式。
-
(4) 向“除铜”后的滤液中加入NaF溶液,使Mg2+转化为MgF2沉淀除去。若溶液的pH偏低,将会导致MgF2沉淀不完全,其原因是。
-
(5) “沉镍”后所得滤液中,可循环使用的主要溶质为(填化学式)。
-
(6) NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的化学方程式为。
-
(7) 在制备NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是。
 下列说法错误的是( )
下列说法错误的是( )
-
(1) 加适量醋酸钠晶体后,醋酸溶液中c(H+)(填“增大”、“减小”或“不变”,下同),盐酸中c(H+)。
-
(2) 加水稀释10倍后,溶液中的c(H+):醋酸 (填“>”、“=”或“<”,下同)盐酸。加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸盐酸。
-
(3) 使温度都升高20℃,溶液中c(H+):醋酸(填“>”、“=”或“<”)盐酸。
-
(4) 分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是(填字母)。(①表示盐酸,②表示醋酸)

-
(5) 将0.1mol∙L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是(填字母)。
a.电离程度增大
b.溶液中离子总数增多
c.溶液导电性增强
d.溶液中醋酸分子增多

请回答下列问题:
-
(1) 组成X的两种元素是,固体G的化学式是
-
(2) 写出溶液C转化为溶液E的离子方程式:
-
(3) 写出化合物X与稀硫酸反应的化学方程式:
-
(4) 请设计实验方案,检验溶液C中的金属阳离子:
 及少量
及少量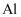 、
、 等)为原料制备
等)为原料制备 。
。
-
(1) 浸取:取一定量废旧锂电池正极材料,粉碎后与
 溶液混合配成悬浊液,加入到如图所示三颈烧瓶中,边搅拌边加入
溶液混合配成悬浊液,加入到如图所示三颈烧瓶中,边搅拌边加入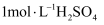 充分反应。
充分反应。 转化为
转化为 、
、 的化学方程式为。从分液漏斗中滴入
的化学方程式为。从分液漏斗中滴入
 时,滴加速率不能太快且需要快速搅拌的原因是。
时,滴加速率不能太快且需要快速搅拌的原因是。
-
(2) 除
 、
、 :向浸取液中先加入足量
:向浸取液中先加入足量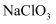 , 再加入
, 再加入 调节
调节 , 过滤。有关沉淀数据如下表(“完全沉淀”时金属离子浓度
, 过滤。有关沉淀数据如下表(“完全沉淀”时金属离子浓度 )。
)。沉淀

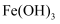

恰好完全沉淀时




若浸取液中
 , 则须调节溶液
, 则须调节溶液 的范围是。(加入
的范围是。(加入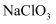 和
和 时,溶液体积的变化忽略不计)
时,溶液体积的变化忽略不计) -
(3) 萃取钴:
 [二(2-乙基己基)磷酸酯,难溶于水,用HA表示]是常用的
[二(2-乙基己基)磷酸酯,难溶于水,用HA表示]是常用的 萃取剂,其结构简式如图所示。萃取过程中发生反应:
萃取剂,其结构简式如图所示。萃取过程中发生反应: 。能使用
。能使用 萃取剂萃取水溶液中
萃取剂萃取水溶液中 的原因是。
的原因是。
-
(4) 制备
 。已知尿素
。已知尿素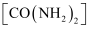 在水溶液中加热可发生水解反应。
在水溶液中加热可发生水解反应。 和
和 在空气中加热至
在空气中加热至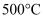 均可得到
均可得到 。为获得较高纯度的
。为获得较高纯度的 , 请补充实验方案:取一定量
, 请补充实验方案:取一定量 溶液置于
溶液置于 水浴槽中,,得
水浴槽中,,得 。(须使用的试剂:尿素浓溶液、
。(须使用的试剂:尿素浓溶液、 溶液、蒸馏水)
溶液、蒸馏水)
A | B | C |
①球棍模型为 ②能和Cl2在光照条件下反应生成多种氯代物 | ①能使溴水褪色 ②标准状况下,气体密度为1.25g•L-1 | ①能使溴水褐色 ②1molC能和2molH2发生加成反应 ③空间充填模型为 |
-
(1) 烃分子C的空间结构为。
-
(2) 三种烃中,和甲烷互为同系物的是(填结构简式,下同);完全燃绕,生成CO2和H2O的物质的量之比为1:1的是。
-
(3) 烃B能使溴水褪色,其原因为(用化学方程式表示),反应类型为。
-
(4) 已知B和C具有相似的化学性质,将烃C通入少量酸性KMnO4溶液中的现象是。
 既是一种化工产品,同时也是重要的化工原料。以氨气作原料可制备叠氮化钠(NaN3)可用于合成抗生素头孢菌素药物和汽车安全气囊的气源。
既是一种化工产品,同时也是重要的化工原料。以氨气作原料可制备叠氮化钠(NaN3)可用于合成抗生素头孢菌素药物和汽车安全气囊的气源。
-
(1) Ⅰ.实验室中制备NaN3分2步进行:
①制备氨基钠:
 , 装置如下图。已知氨基钠极易与水剧烈反应生成
, 装置如下图。已知氨基钠极易与水剧烈反应生成 , 且易被空气氧化。
, 且易被空气氧化。
②制备叠氮化钠:将得到的
 与
与 在210~220℃的条件下反应生成
在210~220℃的条件下反应生成 和
和 。
。盛放浓氨水的仪器名称为,B的作用是。
-
(2) 连接好装置并检查装置的气密性后,装入试剂,然后应先。
a.向A中加入浓氨水 b.加热装置C
-
(3) 若无B装置,C中生成的氨基钠会发生的化学方程式为。
-
(4) D装置中长导管不伸入液面的目的是。
-
(5)
 可由
可由 (熔点169.6℃)在185~200℃分解制得,最好选用的气体发生装置是(填标号)。
(熔点169.6℃)在185~200℃分解制得,最好选用的气体发生装置是(填标号)。a.
 b.
b.  c.
c. 
-
(6) Ⅱ.测定的纯度
精确称量
 样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。已知:
样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。已知: (其他产物略),反应中放出大量的热。
(其他产物略),反应中放出大量的热。
常温下测得产生气体的体积为45.00mL (
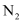 的密度为1.400g/L),计算
的密度为1.400g/L),计算 样品的纯度为(质量分数)。
样品的纯度为(质量分数)。
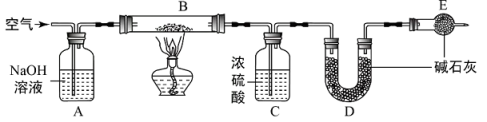
【资料】
a.浓硫酸常用于吸收水蒸气;
b. 碱石灰是固体氢氧化钠和氧化钙的混合物。
-
(1) 装置E的名称是。
-
(2) 完成该实验要进行以下操作,正确的操作顺序为。
①点燃酒精灯 ②熄灭酒精灯 ③连接上D、E装置 ④通入一段时间的空气 ⑤再通入一段时间的空气
-
(3) 实验中称取膨松剂6.0g,实验结束后装置(填装置对应的字母符号)增重1.32g,即为样品产生二氧化碳的质量。实验过程中装置B发生反应的化学方程式为,该膨松剂的该项指标为mL/g 。




