化学实验 知识点题库

已知:25 ℃时,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11。
-
(1) 流程中含锰废水经过前三步预处理,得到主要含有Mn2+的母液。
①除铁铝时,在搅拌条件下先加入H2O2溶液,再加入NaOH溶液调节pH。加入H2O2溶液时发生反应的离子方程式为。
②除钙镁步骤中,当Ca2+、Mg2+沉淀完全时,溶液中
 =。
=。
-
(2) 沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。
①沉锰过程发生反应的离子方程式为。该过程中加入适当过量的NH4HCO3的原因是。
②当温度超过30 ℃,沉锰反应的锰沉淀率随温度升高而下降的原因是。
-
(3) 沉锰后过滤得到MnCO3粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的MnCO3。用无水乙醇洗涤的目的是。
 、
、  、
、  、
、  这四种无色溶液区分开的一种试剂是(必要时可加热)( )
这四种无色溶液区分开的一种试剂是(必要时可加热)( )
 溶液
B .
溶液
B .  溶液
C .
溶液
C .  溶液
D .
溶液
D .  溶液
溶液
 的制取装置如图所示。下列编号仪器的名称正确的是( )
的制取装置如图所示。下列编号仪器的名称正确的是( ) 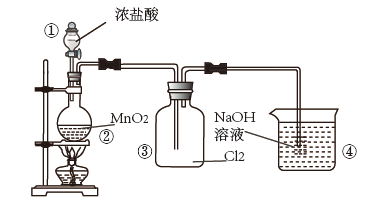
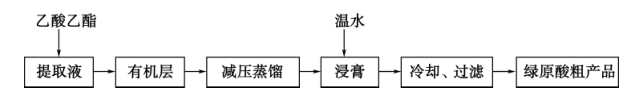
下列说法错误的是( )

 ,
,  与
与  互为同位素
C . “凡酸坏之酒,皆可蒸烧”中涉及蒸馏操作
D . 古代的鎏金工艺利用了电解原理
互为同位素
C . “凡酸坏之酒,皆可蒸烧”中涉及蒸馏操作
D . 古代的鎏金工艺利用了电解原理
-
(1) 实验一:取3mol/L的H2O2溶液各10mL分别进行下列实验,实验报告如下表所示。
序号
V(过氧化氢溶液)/mL
V(氯化铁溶液)/mL
二氧化锰质量/g
反应温度/℃
V(水)/mL
结论
1
10
2
0
50
8
2
10
2
0
30
8
3
10
0
1
30
a
①实验1、2研究的是对H2O2分解速率的影响。
②表中数据a的值应该为;实验2、3研究的是对H2O2分解速率的影响。
③如果实验3中30s时共收集到气体的体积为11.2mL(已折算成标准状况下),则用过氧化氢表示的0~30s的平均反应速率为mol/(L·min)。
-
(2) 实验二:查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:


①定性分析:如图甲可通过观察,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是。
②定量分析:如图乙所示,实验时以收集到40mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是。
-
(3) ①H2O2溶液在Fe3+催化下分解的反应历程如下:
第一步反应历程为:2Fe3++H2O2=2Fe2++O2+2H+
第二步反应历程为:;
②该小组预测同为第四周期VIII族的Fe、Co、Ni可能有相似的催化作用。查阅资料:CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。

a.由图中信息可知法制取得到的催化剂活性更高。
b.推测Co2+、Ni2+两种离子中催化效果更好的是。
 常作为芳烃氯代反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳和
常作为芳烃氯代反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳和  杂质)为原料制备无水
杂质)为原料制备无水  。
。 已知:氯化亚砜( ![]() )熔点-101℃,沸点76℃,易水解。
)熔点-101℃,沸点76℃,易水解。

回答问题:
-
(1) 操作①是过滤,用到的玻璃仪器有烧杯、玻璃棒和。
-
(2) 为避免引入新的杂质,试剂B可以选用___________(填编号)。A .
 溶液
B .
溶液
B .  水
C .
水
C .  水
D .
水
D .  溶液
溶液
-
(3) 操作②是蒸发结晶,加热的同时通入
 的目的是。
的目的是。
-
(4) 取少量
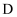 晶体,溶于水并滴加
晶体,溶于水并滴加 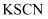 溶液,现象是。
溶液,现象是。
-
(5) 反应
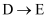 的化学方程式为。
的化学方程式为。
-
(6) 由
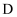 转化成
转化成 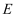 的过程中可能产生少量亚铁盐,写出一种可能的还原剂,并设计实验验证是该还原剂将
的过程中可能产生少量亚铁盐,写出一种可能的还原剂,并设计实验验证是该还原剂将  还原。
还原。
-
(1) 配制该 NaOH 溶液需用电子天平(精确度 0.01g)称取 NaOH 固体g。
-
(2) 配制时,其正确的操作顺序是(填序号,每个操作只用一次)。
①用少量蒸馏水洗涤烧杯内壁和玻璃棒 2-3 次,洗涤液均注入容量瓶,振荡
②在盛有 NaOH 固体的烧杯中加入适量水溶解
③将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
④将容量瓶盖紧,反复上下颠倒,摇匀
⑤改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
⑥继续往容量瓶内小心加水,直到液面接近刻度线 1-2cm 处
-
(3) 实际配制得到的溶液浓度偏低,可能的原因是 (填字母)。A . 容量瓶用蒸馏水洗净后,未待干燥便用来配制 B . 固体溶解后趁热移入容量瓶中 C . 定容时,仰视刻度线 D . NaOH 固体已变质
-
(4) 某同学需要 100mL0.1mol/L NaOH 溶液,需要取上述 NaOH 溶液mL,该稀溶液配置过程中还需要增加使用的仪器是。


回答下列问题:
-
(1) NH4Fe(SO4)2·12H2O中Fe元素的化合价为。步骤①通常用热的纯碱溶液去除废铁屑表面的油脂效果较好,请结合平衡原理和离子方程式阐述其原理:。
-
(2) 为加快步骤②酸溶的速率,除升高温度外,还可以采取的措施有(任写一条),温度不宜高于100℃,否则将产生浓烈的刺激性气味,原因是生成了气体。
-
(3) 步骤③发生反应的离子方程式为。
-
(4) 表中数据为研究步骤③反应过程中溶液酸度对产品产量和反应速率的影响数据。pH过大,产品产率下降的可能原因为,最佳的pH控制范围为。
溶液酸度对硫酸铁铵产量和反应速率的影响
序号
溶液pH
反应时间/min
硫酸铁铵产量/g
硫酸铁铵产率/%
1
≤0.5
4.0
34.0
98.75
2
0.5~1.0
4.3
33.4
97.01
3
1.0~1.5
4.8
22.2
64.48
4
1.5~2.0
5.2
19.2
55.71
-
(5) 步骤⑤的具体操作有蒸发浓缩、、,经干燥得到硫酸铁铵晶体。
 ,
,  ,
,  。下列说法错误的是( )
。下列说法错误的是( )
 , “除铁”操作中可以调节pH的范围是3
, “除铁”操作中可以调节pH的范围是3 时,表示该离子沉淀完全)
时,表示该离子沉淀完全)
-
(1) Ⅰ.“钠在空气中燃烧”实验深度探究
Na在空气中燃烧主要产物是(填化学式)。
-
(2) 钠在空气中燃烧后生成的固体粉末中还含有黑色固体物质。通过查阅文献发现,有一种观点认为该黑色固体物质是C和铁的氧化物。
ⅰ.生成C的原因是CO2和Na在加热条件发生如下反应,请配平该化学方程式,并用单线桥表示出电子转移的方向和数目:
CO2+Na= Na2CO3+C
-
(3) ⅱ.产生铁的氧化物的原因是Na单质中含有0.002%左右的铁元素,在钠燃烧的时候铁被氧化为铁的氧化物。为了检验黑色固体物质中是否含有铁元素,进行了如下实验:
实验内容
实验现象
实验结论
①收集黑色固体物质溶于稀硫酸中
少量黑色固体物质不溶解
②取上层清液少许于一支试管中,滴入KSCN溶液
溶液变为红色
-
(4) Ⅱ.“纯碱和小苏打”性质实验的深度探究
该组同学利用下图对“碳酸钠溶液与盐酸反应”进行探究
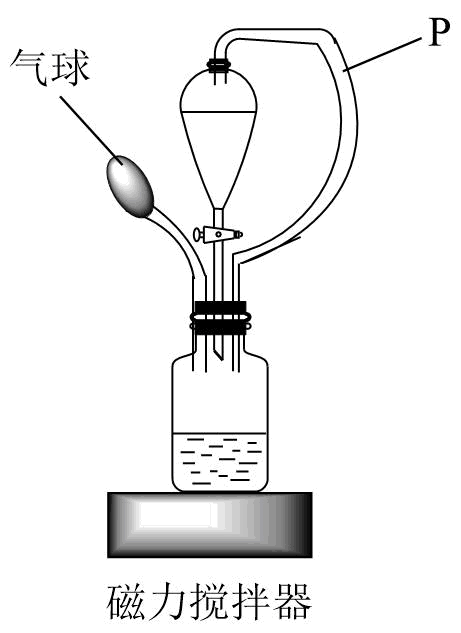
导管P的作用是。
-
(5) 开始实验;
ⅰ.广口瓶中预先盛放10 mL 1 mol/L的Na2CO3溶液,将分液漏斗中10 mL 1 mol/L的HCl溶液缓缓滴入到广口瓶中,观察到的现象是,在分液漏斗再加10 mL 1 mol/L的HCl溶液并滴入广口瓶,发生反应的离子方程式为。
ⅱ.广口瓶中预先盛放10 mL 1 mol/L的HCl溶液,将分液漏斗中的10 mL 1 mol/L Na2CO3溶液中的5 mL溶液快速滴入到广口瓶中,立刻有大量气泡产生,气球膨胀。再将剩余的5 mL 1 mol/L的Na2CO3溶液加入到广口瓶中,几分钟后,气球变扁,变扁的原因是(用化学方程式作答)。
-
(6) 实验结论:
a.Na2CO3与盐酸反应是分步进行的;
b.碳酸钠和碳酸氢钠在一定条件下可以相互转化;
c.
 和
和 中结合H+能力较强的是(填离子符号)。
中结合H+能力较强的是(填离子符号)。
 溶液中
C .
溶液中
C .  溶液稍过量
D . 用玻璃搅拌器而不用铜制搅拌器
溶液稍过量
D . 用玻璃搅拌器而不用铜制搅拌器

已知:
①Al元素及Si元素在水溶液中的主要存在形式与pH的关系为:

②V2O5为两性氧化物:在水溶液中存在:VO +2H+⇌VO
+2H+⇌VO +H2O;钒元素常见的化合价及其在水溶液中的存在形式如下:
+H2O;钒元素常见的化合价及其在水溶液中的存在形式如下:
价态 | +5 | +4 | +3 | +2 |
存在形式 | VO | VO2+ | V3+ | V2+ |
回答下列问题:
-
(1) “碱浸”时,滤液中的金属含氧酸根离子除WO
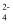 外还有。
外还有。
-
(2) “调节pH”时,所调pH的范围是。
-
(3) “沉钒”过程中:
①沉钒率随溶液pH的变化如下图所示。沉钒率随溶液pH值的增加先升高后降低的原因可能是。

②已知25℃时,Kb(NH3·H2O)=1.8×10-5 , Ksp(NH4VO3)=3.0×10-8。若25℃时控制“沉钒”的pH为8.0,当VO
 恰好完全沉淀时,溶液中的c(NH3·H2O)=mol·L-1。
恰好完全沉淀时,溶液中的c(NH3·H2O)=mol·L-1。 -
(4) 常温下,钨酸(H2WO4)是一种难溶于水的弱酸。“沉钨”过程中发生反应的离子方程式为;“沉钨”后需对滤渣2进行洗涤、干燥,判断滤渣2已洗涤干净的方法为。
-
(5) V2O5具有强氧化性,可与浓盐酸发生反应生成气体单质,该反应中氧化剂与还原剂的物质的量之比为1:2,则反应的化学方程式为。
选项 | 实验操作与现象 | 实验结论 |
A | 将花生油与NaOH溶液混合,充分加热后分层消失 | 花生油在水中的溶解度随温度升高而增大 |
B | 向5mL0.1mol·L-1的KI溶液中滴加1mL0.1mol·L-1FeCl3溶液,再滴加KSCN溶液,溶液变红 | FeCl3与KI溶液的反应是有一定限度的 |
C | 向漂白粉溶液中通入足量SO2 , 产生白色沉淀 | 酸性:H2SO3>HClO |
D | 常温下,用pH计测得CH3COONa溶液的pH小于同浓度Na2CO3溶液的pH值 | 酸性:CH3COOH>H2CO3 |
选项 | 不纯物质 | 检验 | 除杂 |
A | NO2中混有少量NO | 观察颜色 | 依次通过水、浓硫酸 |
B | 甲烷中混有少量乙烯 | 溴水 | 依次通过酸性KMnO4溶液、浓硫酸 |
C | CO中混有少量CO2 | 澄清石灰水 | 依次通过氢氧化钠溶液、浓硫酸 |
D | Na2CO3溶液中混有少量NaHCO3 | Ca(OH)2溶液 | 加入适量的NaOH溶液 |
实验 | 操作 | 现象 | 结论 |
A | 在一支试管中加入 | 没有砖红色沉淀生成 | 麦芽糖不是还原糖 |
B | 取少量铁在氯气中燃烧后的固体粉末加入蒸馏水溶解,取上层清液,加几滴 | 无血红色 | 固体粉末中不含 |
C | 向某无色溶液滴加少量溴水,再加 | 溶液分层且下层溶液显紫色 | 该无色溶液中可能含有碘离子 |
D | 用pH试纸分别测定等物质的量浓度的 | pH:
| 酸性:
|
 的
的 溶液,加入5滴
溶液,加入5滴 的
的 溶液
溶液
 , 振荡后静置,
, 振荡后静置, 和
和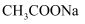 溶液的pH值
溶液的pH值




