物质的分离、提纯和检验 知识点题库
(一定条件下,MnO4﹣可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
|
|
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀时 |
3.4 |
6.3 |
2.7 |
|
完全沉淀时 |
5.2 |
9.7 |
3.2 |
-
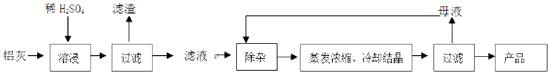
(1) H2SO4溶解Al2O3的离子方程式是;
-
(2) 检验滤液中还存在Fe2+的方法是(注明试剂、现象).
-
(3) “除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的;调节溶液的pH为3.2的目的是.
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是,写出其反应方程式;
③Ⅲ中加入MnSO4的目的是.
-
(4) 从多次循环使用后母液中可回收的主要物质是(填化学式).

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO2 , Na2ZrO2与酸反应生成ZrO2+
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如下表•
离子 | Fe3+ | AP+ | ZrO2+ |
开始沉淀pH | 1.9 | 3.3 | 6.2 |
完仝沉淀pH | 3.2 | 5.2 | 8.0 |
-
(1) 经熔融后,锆英砂中Zr元素以(写化学式)形式存在,写出酸浸时生成Al3+、Fe3+的离子方程式:
-
(2) 滤渣I的主要成分的名称为
-
(3) 向过滤Ⅰ所得溶液中加氨水调pH=a,其目的是然后继续加氨水至pH=b的范围是
-
(4) 向过滤Ⅲ所得溶液中加入CaCO2粉末并加热,可得CO2和另一种气体,该反应的离子方程式为
-
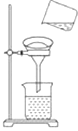
(1) 将样品置于烧杯中,加入适量的水溶解,同时用玻璃棒搅拌,搅拌的作用是
-
(2) 向溶液中加入适量的溶液,使Cl﹣转化为沉淀.
-
(3) 混合液进行过滤,过滤装置和操作如图,指出上图中的两处错误:①;② .
-
(4) 为了从滤液中得到硝酸钾固体,可选用的实验方法是.
物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g·cm–3 | 溶解性 |
乙二醇 | C2H4O2 | –11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
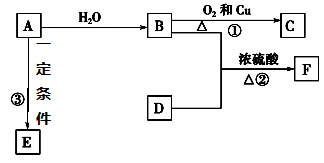
-
(1) A的结构式为,F的名称为。
-
(2) 写出反应的化学方程式
①,反应类型为。
②,反应类型为。
③
-
(3) 实验室怎样鉴别B和D?。
-
(4) 在实验室里我们可以用如图所示的装置来制取F,乙中所盛的试剂为,该装置图中有一个明显的不正确是。
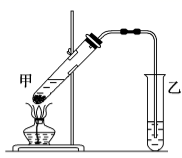
-
(5) 写出F的同分异构体中与D互为同系物的有机物的所有结构简式:。
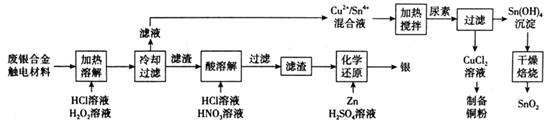
回答下列问题:
-
(1) “加热溶解”时Cu发生的离子方程式为。
-
(2) “加热溶解”时温度常控制在50℃左右,温度不宜过高也不宜过低的原因为。
-
(3) “酸溶解”过程中会产生少量遇空气变为红棕色的无色气体,则“酸溶解”过程主要的化学方程式为。
-
(4) 常温下,Cu2+/Sn4+混合液中c(Cu3+)=0.022mol·L-1 , 将混合液“加热搅拌”后冷却至室温,再加“尿素”调节溶液的pH范围为。(当溶液中的离子浓度小于10-5mol·L-1时,沉淀完全,已知:Ksp[Sn(OH)4]=1×10-55;Ksp[Cu(OH)2]=2.2×10-20)
-
(5) 检验Sn(OH)4沉淀是否洗涤干净的方法是。
-
(6) 用惰性电极电解CuCl2溶液,阴极反应式是,若想由CuCl2溶液得到无水CuCl2固体,则需进行的实验操作为。
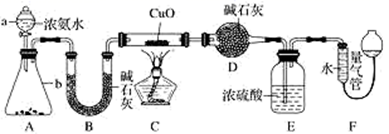
-
(1) 仪器a的名称为;仪器b中可选择的试剂为(填名称)。
-
(2) 实验室中,利用装置A,还可制取的无色气体是______ (填字母)。A . Cl2 B . O2 C . CO2 D . NO2
-
(3) 实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有性,写出相应的化学方程式。
-
(4) E装置中浓硫酸的作用。
-
(5) 读取气体体积前,应对装置F进行的操作:。
-
(6) 实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为(用含m、n字母的代数式表示)。
 ,还含有少量Fe、Si等杂质元素)制备高纯碳酸锰的流程如下:
,还含有少量Fe、Si等杂质元素)制备高纯碳酸锰的流程如下: 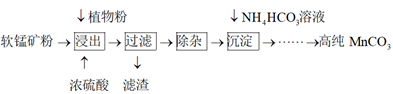
其中除杂过程包括:①室温下,向滤液中加入一定量的试剂X,调节滤液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水(  ),过滤。已知:室温下,
),过滤。已知:室温下,  。下列说法正确的是( )
。下列说法正确的是( )
 D . “沉淀”时加入过量的
D . “沉淀”时加入过量的 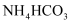 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为 
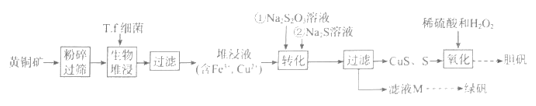
已知:①T.f细菌在1.0<pH<6.0范围内保持生物活性。
②几种离子形成氢氧化物沉淀的pH如表所示:
|
Fe3+ |
Fe2+ |
Cu2+ |
|
|
开始沉淀时的pH |
1.9 |
7.0 |
4.2 |
|
完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
回答下列问题:
-
(1) 从物质分类的角度看,本题中涉及的“矾”属于 (填序号)。
A.化合物 B.硫酸盐 C.混合物 D.复盐
为了提高生物堆浸速率,上述流程采用的措施是。
-
(2) 生物堆浸包括两个过程:
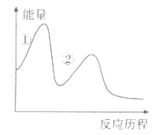
①CuFeS2+4H++O2=Cu2++Fe2++2S+2H2O;②(补充离子方程式)。
这两个过程中的能量变化如图所示,其中控制生物堆浸总速率的是 (填“①”或“②")。生物堆浸过程中应控制溶液pH的范围为。
-
(3) 检验滤液M中是否含硫酸铁的试剂为(填化学式)。在确定无Fe3+后,滤液M先加入少量稀硫酸,目的是。然后经过、洗涤、干燥制得绿矾。
-
(4) 测定绿矾(FeSO4·7H2O,式量为278)样品的纯度。取wg绿矾样品溶于稀硫酸中,配制成100 mL溶液。取25.00 mL配制溶液于锥形瓶中,将c mol·L-1标准KMnO4溶液装入(填酸式、碱式)滴定管进行滴定至终点,三次平行实验所消耗溶液体积依次为25.00mL、24.95mL、25.05mL,该绿矾样品的纯度为(用含w、c的代数式表示)。
已知:亚油酸甘油酯沸点 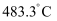 ;乙醚熔点
;乙醚熔点 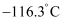 ,沸点
,沸点  ,易燃。
,易燃。
回答下列问题:
-
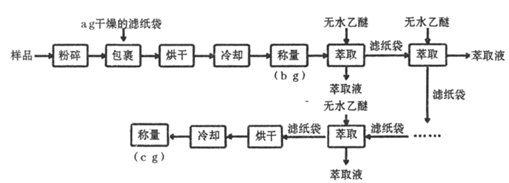
(1) 实验中两次“冷却”均在干燥器中进行,其目的是。
-
(2) 上述实验中多次“萃取”均在下列仪器中进行(填字母标号)。

a
b
c
-
(3) 为了克服多次萃取实验操作繁琐,萃取剂消耗量过大的缺点, Franz von Soxhlet发明了索氏抽提筒。若将上述实验的多次萃取改为在下图装置中进行(约需10~12h):
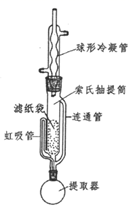
①为提高乙醚蒸气的冷凝效果,球形冷凝管可改用(填仪器名称)。实验中常在冷凝管上口连接一个装有活性炭的球形干燥管,其目的是。
②实验中需控制提取器(烧瓶)温度在60℃~70℃之间,应采取的加热方式是。
③索氏提取法原理:当无水乙醚加热沸腾后,蒸气通过(填字母标号,下同)上升,被冷凝为液体滴入抽提筒中,当液面超过最高处时,萃取液即回流入提取器(烧瓶)中……如此往复。
a.冷凝管 b.虹吸管 c.连通管
④索氏提取法存在的明显缺点是。
-
(4) 数据处理:样品中纯脂肪百分含量(填“<”、“>”或“=”)
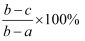 ,原因是。
,原因是。
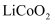 以及少量Ca、Mg、Fe、Al等)制备
以及少量Ca、Mg、Fe、Al等)制备  和
和 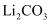 的工。艺流程如下:
的工。艺流程如下: 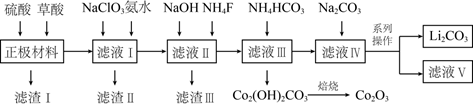
已知:①草酸(  )是一种二元弱酸,不稳定易分解,具有还原性。
)是一种二元弱酸,不稳定易分解,具有还原性。
②常温时,有关物质  如下表(单位已略):
如下表(单位已略):
| | | | | | | | | |
| | | | | | | | | |
③当离子浓度  ,可认为沉淀完全。
,可认为沉淀完全。
④常温下 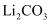 的溶解度为
的溶解度为 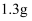 ,
, 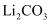 的溶解度随温度的升高而逐渐减小。
的溶解度随温度的升高而逐渐减小。
回答下列问题:
-
(1) 拆解后的“正极材料”需按先后顺序加酸,最后加入的是(填“硫酸”或“草酸”),溶解
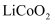 的反应的离子方程式为。
的反应的离子方程式为。
-
(2) “滤液Ⅰ”中加入氨水调
 为5,则“滤渣Ⅱ”的主要成分是(填化学式)。若先调节
为5,则“滤渣Ⅱ”的主要成分是(填化学式)。若先调节  并控制到5,再加入
并控制到5,再加入 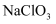 ,则
,则  被氧化时的离子方程式为。
被氧化时的离子方程式为。
-
(3) 若取
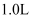 “滤液Ⅱ”,测得
“滤液Ⅱ”,测得  、
、  浓度均为
浓度均为  ,则至少需加入g(保留到小数点后1位)
,则至少需加入g(保留到小数点后1位) 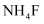 固体才能使
固体才能使  沉淀完全。
沉淀完全。
-
(4) 在空气中“焙烧”
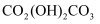 的化学方程式为。
的化学方程式为。
-
(5) 为了获得更多更纯的
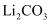 固体,“系列操作”依次为和干燥。
固体,“系列操作”依次为和干燥。
实验目的 | 实验操作 | |
A | 除去乙烷中的乙烯 | 将混合气体通入酸性高锰酸钾溶液 |
B | 除去乙醇中的水 | 加入生石灰,蒸馏 |
C | 鉴别苯和环己烷 | 加入溴水振荡,静置后观察分层及颜色差异 |
D | 分离苯和溴苯 | 加水后分液 |
 标准溶液
B . 从食盐水中得到
标准溶液
B . 从食盐水中得到 晶体,当坩埚中出现大量固体时,停止加热,利用余热蒸干
C . 用苯萃取溴水中的
晶体,当坩埚中出现大量固体时,停止加热,利用余热蒸干
C . 用苯萃取溴水中的 , 分离时溴和苯的混合溶液从分液漏斗下口放出
D . 配制一定物质的量浓度溶液时,将量取好的物质放入容量瓶中,加水溶解至刻度线
, 分离时溴和苯的混合溶液从分液漏斗下口放出
D . 配制一定物质的量浓度溶液时,将量取好的物质放入容量瓶中,加水溶解至刻度线
序号 | 物质 | 杂质 | 试剂 | 方法 |
A |
|
|
| 蒸馏 |
B |
|
|
| 加热 |
C |
|
| NaOH溶液 | 洗气 |
D |
|
| 饱和 | 洗气 |
 、
、 等物质,其中铺有
等物质,其中铺有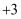 、
、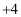 两种价态,
两种价态, 具有强氧化性,与常见的无机酸不反应):
具有强氧化性,与常见的无机酸不反应):
-
(1) 步骤Ⅰ和步骤Ⅱ进行的实验操作是。
-
(2) 步骤Ⅱ的离子方程式是;为了加快步骤Ⅱ的反应速率,有人提出在较高温度下进行,你认为是否合适,解释理由。
-
(3) 固体B的主要成分化学式是,说出该物质两个主要用途。
-
(4) 可否省掉真空加热这一步,对
 溶液直接加热蒸干而得到
溶液直接加热蒸干而得到 , 请说明理由。
, 请说明理由。
-
(5) 步骤IV的化学方程式是。
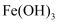

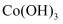
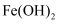

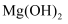
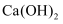



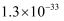
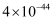
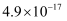

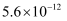
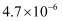
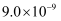
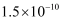


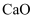






 溶液
溶液


