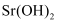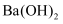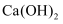物质的分离、提纯和检验 知识点题库
①固定铁圈位置②放置酒精灯③放上石棉网④放上蒸发皿⑤加热搅拌⑥停止加热、余热蒸干
其操作顺序为( )
-
(1) 实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌; ⑤停止加热.其正确的操作顺序为
-
(2) 如何运用最简方法检验溶液中有无SO42﹣离子? .如果有,应该如何除去SO42﹣离子?
-
(3) 在粗盐经过溶解→过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止.请问这步操作的目的是
-
(4) 将经过操作(3)后的溶液过滤.请问这一操作能除掉哪些杂质?
-
(5) 实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时: .过滤时: .蒸发时: .
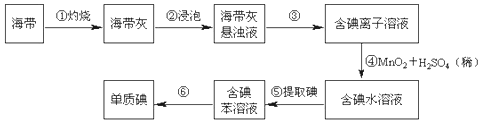
现有下列仪器,请按要求填写以下空白:
-
(1) 其中适用于物质分离的仪器有(填名称),使用前需要检验是否漏水的有(填序号).

-
(2) 步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处).A . 烧杯 B . 坩埚 C . 表面皿 D . 泥三角 E . 酒精灯 F . 干燥器
-
(3) 步骤③除铁架台、烧杯外,还需用到的仪器有;
-
(4) 步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是,上图中还缺少的玻璃仪器是.
 B .
B .  C .
C .  D .
D . 
 2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
-
(1) CCl4 和蒸馏水都是无色液体,请按下列要求用实验方法鉴别两者:
① 只允许用一种试剂:用两支试管分别取出少量的 CCl4和 蒸馏水 ,然后分别加入少量 的单质碘,振荡,呈紫红色的液体 是 ,呈棕黄色的液体是 .
② 不用任何试剂:用试管取少量的其中一种液体,再加入另外一种液体,下层液体是,上 层液体是。
-
(2) NaCl溶液中含有少量的CaCl2 , 某学生用过量的 Na2CO3使 Ca2+转化为沉淀而除 去,确认Na2CO3已 过量的实验 方法 是 : .
-
(3) 氢氧化铁胶体的制备方法是。发生反应的化学方程式为。
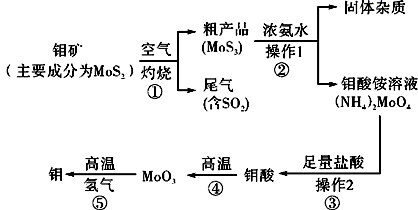
-
(1) 反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂:。
-
(2) 如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有:。
-
(3) 钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为。
-
(4) 工业上制备还原性气体CO和H2的反应原理为CO2+CH4
 2CO+2H2 , CH4+H2O
2CO+2H2 , CH4+H2O  CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为。
| 选项 | 目的 | 分离方法 | 原理 |
| A. | 分离苯和苯酚 | 加浓溴水过滤 | 苯酚与浓溴水反应生成白色沉淀 |
| B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C. | 除去乙烯中混有的SO2 | 酸性KMnO4溶液洗气 | SO2能被酸性KMnO4溶液氧化生成SO42— |
| D. | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
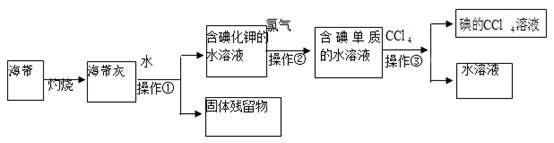
请回答下列问题:
-
(1) 操作①的名称为、;
-
(2) 向含碘单质的水溶液中加入CCl4振荡、静置后,观察到的现象是;
-
(3) 操作③中,将含碘单质的水溶液与CCl4在分液漏斗中混合、振荡摇匀放在铁架台的铁圈上,分液漏斗的下端尖嘴处紧贴在承接的烧杯内壁上静置后,下面的操作步骤是。
-
(4) 从含碘的有机溶剂中经过蒸馏可以提取碘和回收有机溶剂,该实验需要的主要玻璃仪器除酒精灯、烧杯、温度计、锥形瓶、牛角管外,还需要,实验中温度计水银球所处位置为。
-
(1) Ⅰ.工业上常用氯气与石灰乳反应制漂白粉,但Ca(OH)2与Cl2反应的氧化产物与温度有关。在足量的石灰乳中通入一定量的氯气,充分反应后生成Cl-、ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。

常温时工业制漂白粉的化学方程式为。
-
(2) t1时开始有ClO3-生成的原因是。
-
(3) 该石灰乳中参加反应的Ca(OH)2的物质的量是mol(用含a的代数式来表示)。
-
(4) Ⅱ.过氧乙酸(
 )是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。 下列叙述正确的是_________________(填字母)。
A . 过氧乙酸分子中两个氧原子化合价为-1,一个氧原子化合价为-2 B . 过氧乙酸溶于水能导电,属于离子化合物,也属于电解质 C . 过氧乙酸包装上应贴的危险警告标签应如图所示 D . 过氧乙酸应注意密闭、低温保存于棕色细口瓶中
E . 过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
D . 过氧乙酸应注意密闭、低温保存于棕色细口瓶中
E . 过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
-
(5) 某学生在实验室用3.00 mol•L−1过氧乙酸配制0.15 mol•L−1过氧乙酸溶液250 mL,该生用量筒量取工业品过氧乙酸的体积为mL。
-
(6) 如果生产过氧乙酸的原料CH3COONa中混有了SO42- , 要想除掉SO42- , 请选择下列试剂按照加入先后顺序填空(试剂不必选完,填序号)。
①醋酸钡溶液;②醋酸;③硝酸钡溶液;④盐酸;⑤碳酸氢钠溶液;⑥碳酸钠溶液。
 、
、  ,还有少量
,还有少量  、
、  )为原料制备胆矾
)为原料制备胆矾  的工艺流程如下图所示。下列说法错误的( )
的工艺流程如下图所示。下列说法错误的( ) 
 C . “滤渣”的成分为
C . “滤渣”的成分为  D . “胆矾”为纯净物,属于盐类
D . “胆矾”为纯净物,属于盐类
 除去CO2中的HCl
B .
除去CO2中的HCl
B .  分离碘和酒精
C .
分离碘和酒精
C .  实验室制氧气
D .
实验室制氧气
D . 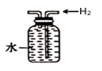 排水法收集氢气
排水法收集氢气
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 肥皂(甘油) | NaCl | 过滤 |
| B | 淀粉溶液(NaCl) | 水 | 渗析 |
| C | CH3CH2OH(CH3COOH) | CaO | 蒸馏 |
| D | 己烷(己烯) | 溴水 | 分液 |
 为白色,难溶于水的固体,在电子工业中有泛应用。一种由天青石精矿(含
为白色,难溶于水的固体,在电子工业中有泛应用。一种由天青石精矿(含 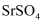 )制备高纯
)制备高纯 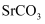 的方法如下:
的方法如下: 天青石精矿  粗
粗 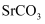
 含
含 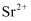 溶液
溶液  高纯
高纯 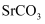
已知:
ⅰ.  、
、 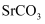 、
、 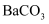 和
和 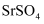 均难溶于水,在相同温度下的溶解度
均难溶于水,在相同温度下的溶解度 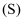 关系如下:
关系如下:
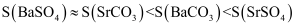
ⅱ.几种氢氧化物在不同温度下的溶解度:
| | 20 | 40 | 60 | 80 | 90 | 100 |
| | 1.77 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
| | 3.89 | 8.22 | 20.94 | 101.4 | - | - |
| | 0.173 | 0.141 | 0.121 | 0.094 | 0.086 | 0.076 |
-
(1) 粗
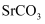 的制取
的制取 ①碳化剂一般选择
 溶液或
溶液或  溶液。写出
溶液。写出 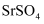 转化为
转化为 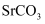 的离子方程式:。
的离子方程式:。②实验发现,当温度和碳化剂的物质的量浓度均相同时,
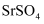 在
在  溶液中的转化速率大于在
溶液中的转化速率大于在  溶液中的。从盐类水解的角度解释其原因是。
溶液中的。从盐类水解的角度解释其原因是。 -
(2) 含
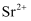 溶液的精制
溶液的精制 ⅰ.将粗
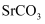 溶解于适量盐酸中,过滤得到滤液(金属阳离子有:
溶解于适量盐酸中,过滤得到滤液(金属阳离子有: 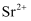 、
、  、
、  和
和  );
);ⅱ.加
 溶液调节上述滤液
溶液调节上述滤液  至12~13.过滤得到滤液X和滤渣A;
至12~13.过滤得到滤液X和滤渣A;ⅲ.将滤液X置于90~95℃的水浴中加热,生成白色沉淀B,趁热过滤弃去沉淀,得到滤液Y,并将ⅱ中的滤渣A重新投入滤液Y中浸泡(保持温度为90~95℃);
ⅳ.重复ⅱ和ⅲ3~4次,最后得到热的滤液Z;
ⅴ.趁热向滤液Z中加入适量稀硫酸,过滤得到精制含
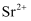 溶液。
溶液。①滤渣A中含有
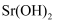 和。
和。②白色沉淀B的主要成分是。
③ⅳ的目的是。
④ⅴ中反应的离子方程式是。
 、HCO
、HCO 、SO
、SO 、Cl-中的一种或几种。为了确定该溶液的成分,进行如下实验:
、Cl-中的一种或几种。为了确定该溶液的成分,进行如下实验:①取少量该溶液加入足量氯水,有气体产生,得到甲溶液;
②取少量甲溶液,向其中加入硝酸酸化的硝酸银溶液,产生白色沉淀甲;
③取少量原溶液,向其中加入Ba(OH)2溶液,产生白色沉淀乙,加足量稀盐酸,沉淀部分溶解。下列关于原溶液说法正确的是( )
 、Cl-
B . 肯定不存在Ba2+ , 可能存在Cu2+
C . CO
、Cl-
B . 肯定不存在Ba2+ , 可能存在Cu2+
C . CO 、HCO
、HCO 至少存在一种
D . 是否存在Na+需要通过焰色试验来确定
至少存在一种
D . 是否存在Na+需要通过焰色试验来确定