物质的分离、提纯和检验 知识点题库
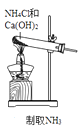
无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过图实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )

-
(1) 0.5molCH4中含有个甲烷分子(阿伏加德罗常数用NA表示),在标准状况下的体积为 L.0.1molH2SO4中含 molH原子,溶于水配成100mL水溶液后c(H+)=.
-
(2) 在反应3Zn+2Fe3+═3Zn2++2Fe中,Fe3+是(填“氧化”或“还原”)剂,1molZn完全反应转移的电子数为 mol.
-
(3) 选择下列实验方法分离物质,将分离方法的序号填在横线上(单选).
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
①分离粗盐中混有的泥沙.②分离碘和水的混合物.
③分离水和汽油的混合物.④分离酒精和水的混合物.
-
(4) 有下列三组物质①CaO、SO3、SO2、P2O5 ②HNO3、H2SO4、HCl、NaCl③KClO3、KCl、KMnO4、HgO各组中均有一种物质所属类别与其他物质不同,这三种物质分别是:①;②;③.


下列说法正确的是( )

-
(1) 写出上述实验过程中所用试剂(写化学式):
试剂①;试剂③.
-
(2) 判断试剂①已过量的方法是:.
-
(3) 用化学方程式表示加入试剂②的作用:
-
(4) 操作①是利用半透膜进行分离提纯.操作①的实验结果:淀粉(填“能”或“不能”)透过半透膜;SO42﹣(填“能”或“不能”)透过半透膜;请用实验证明上述结果,完成下表(可不填满,也可增加):限选试剂:1mol/L AgNO3溶液、1mol/L BaCl2溶液、1mol/L Ba(NO3)2溶液、碘水、稀盐酸、稀硝酸
编号
实验操作
预期现象和结论
①
②
 B .
B .  C .
C . 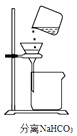 D .
D . 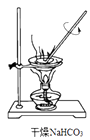
-
(1) 电解之前,食盐水需要精制,目的是除去粗盐的中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:①Na2CO3溶液 ②Ba(OH)2溶液 ③稀盐酸。其中合理的加入顺序为 (填序号);
-
(2) 实验室欲配制6.00 mol/L的食盐水90 mL,回答下列问题:
①需要纯净的NaClg。
②可供选择的仪器有:a玻璃棒 b烧瓶 c烧杯 d胶头滴管 e试管 f托盘天平、砝码 h药匙。在配制食盐水时不需要使用的有(填字母),还缺少的仪器是。
③配制溶液时,一般可以分为以下几个步骤:计算®称量®溶解()转移()定容()装瓶。
④下列操作会使所配溶液的浓度偏小的是。
A. 转移完溶液后未洗涤玻璃棒和烧杯
B. 容量瓶中原来有少量蒸馏水
C. 定容时,俯视刻度线
D. 称量氯化钠固体时左码右物
-
(3) 在电解饱和食盐水过程中,还生成了H2和NaOH,则所发生反应的化学反应方程式为;
-
(4) 将电解生成的Cl2通入NaOH溶液,生成两种盐,其中一种是消毒液的主要成分NaClO,应用氧化还原反应原理,写出此反应的化学方程式是。
 分离CH3COOH和CH3COOC2H5混合液
B .
分离CH3COOH和CH3COOC2H5混合液
B .  验证NH4NO3晶体溶于水的热效应
C .
验证NH4NO3晶体溶于水的热效应
C .  蒸发FeCl3溶液得到FeCl3固体
D .
蒸发FeCl3溶液得到FeCl3固体
D .  验证C、Cl、Si的非金属性强弱
验证C、Cl、Si的非金属性强弱
 、NO
、NO  、SO
、SO  、Cl-中的一种(离子不能重复),进行如下实验:
、Cl-中的一种(离子不能重复),进行如下实验: ①分别溶于水,只有C溶液呈蓝色;
②若把足量盐酸分别加入到上述四溶液,B中出现沉淀,D溶液有无色无味的气体放出;根据①②的实验事实,可推断它们的化学式为:
-
(1) A;B。
-
(2) 以铜为原料,写出能生成C的化学方程式(不限步骤) :。
-
(3) 加入足量盐酸后D中反应的离子方程式:。
-
(4) 写出C与Ba(OH)2溶液反应的离子方程式:。
-
(5) 某溶液中含有较大量的Cl-、CO
 、OH-如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序 正确的是。(填写序号,可重复使用)①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
、OH-如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序 正确的是。(填写序号,可重复使用)①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液

-
(1) 滴加溶液A至图(Ⅱ)中曲线最低点时,灯泡可能熄灭,溶液A中含有的溶质可能是。(填序号)
①HCl ②H2SO4 ③NaHSO4 ④NaHCO3
关于图(Ⅱ)下列说法中错误的是()
A 反应前一段导电能力不断减弱,说明生成的BaSO4是非电解质
B 图(Ⅱ)中最低点导电能力约为零说明溶液中几乎没有自由移动的离子
C 图(Ⅱ)中最低点导电能力约为零时,Ba(OH)2溶液与稀硫酸恰好完全中和
D Ba(OH)2 、H2SO4 和BaSO4都是电解质
-
(2) 请回答下列问题:
①写出NaHSO4在水溶液中的电离方程式。
②NaHSO4属于(填“酸”“碱”或“盐”)。
③将NaHSO4溶液中逐滴加入Ba(OH)2溶液中能否出现如图(Ⅱ)的导电性曲线()
A 能 B 否
-
(3) 用一种试剂除去下列各物质中的杂质(括号内的物质),写出所用的试剂及反应的离子方程式。
①CaCl2(CaCO3):试剂,离子方程式为;
②O2 (CO2):试剂,离子方程式为。
-
(4) 已知某温度下氯化钠的溶解度为a克,列式表达该温度下饱和氯化钠溶液的质量分数
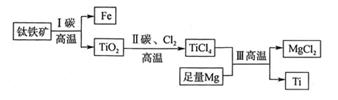
该废铁皮的化学多元素分析结果如下表所示。
|
化学成分 |
FeO |
Fe2O3 |
Fe |
CaO |
CaSiO3 |
其他(C、S等) |
|
含量(%) |
47.35 |
41.92 |
1.07 |
2.64 |
3.48 |
2.68 |
制备流程如下图所示。

-
(1) 废铁皮在焙烧过程中,单质Fe、C、S都可与O2反应,其中S与O2反应的化学方程式是。
-
(2) 在酸溶过程中,为增加溶解速率,可采取的措施是。
-
(3) 过滤操作得到的滤渣中的成分有H2SiO3、。
-
(4) 滤液经检验含有Fe2+ , 检验方案及现象是。
-
(5) 已知:生成氢氧化物沉淀的pH
Fe(OH)2
Fe(OH)3
开始沉淀时
6.3
1.5
完全沉淀时
8.3
2.8
注:金属离子的起始浓度为0.1mol·L-1
加入氨水以控制溶液的pH在(选填序号)。
a.3-5 b.6-8 c.9-10
-
(6) 在搅拌过程中,产生Fe(OH)3的反应方程式有。
-
(7) 对所得高纯氧化铁进行检验,其中Fe2O3含量为95.02%(高于国家一级品技术要求);同时发现还含有0.3%的总钙量(以CaO表示)。产品中含有钙元素的原因是。

已知:Ⅰ.电镀污泥含有Cu(OH)2、Ni(OH)2、Fe(OH)3、Cr(OH)3和SiO2等。
Ⅱ.萃取剂(RH)萃取Ni2+的原理为Ni2++2RH2  NiR2+2H+。
NiR2+2H+。
回答下列问题:
-
(1) “酸浸”时,为加快浸出速率,提高生产效益,下列措施不合理的有___________(填标号)。A . 用机械搅拌器搅拌 B . 体积不变增加硫酸的浓度 C . 进一步球磨粉碎
-
(2) “电解”时,铜的电解电压较低,且电解速率很快,铁和铬存在形式随电解电压的变化如下表。为得到纯的NiSO4·nH2O,电解电压的范围应选择V。
电解电压/V
1.0
1.2
1.5
2.0
2.5
3.0
3.5
Fe2+
有
有
有
无
无
无
无
Cr4+
无
无
无
无
无
有
有
-
(3) 萃取余液可在中循环利用(填操作单元),反萃取剂X为(填化学式)。
-
(4) “反萃取”得到的NiSO4溶液,可在强碱溶液中被NaClO氧化,得到用作镍镉电池正极材料的NiOOH。该反应的离子方程式为。NiSO4溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作可得NiSO4·nH2O。下列说法正确的是(填标号)。
A.为得到较大NiSO4·nH2O晶体颗粒,宜用冰水快速冷却结晶
B.蒸发浓缩至溶液表面出现晶膜时,停止加热
C.可通过抽滤提高过滤速度,在80℃鼓风干燥,快速得到干燥晶体
D.向冷却结晶后的固液混合物中加入乙醇可提高产率
-
(5) 采用热重分析法测定NiSO4·nH2O样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如下图,A点时失掉2个结晶水,n的值为;C点产物的化学式为。

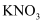 固体,采用溶解、蒸发结晶、趁热过滤、冷却结晶的方法
D . 中学实验室中可以将未用完的钠、钾、白磷等丢弃至实验水池进行处理
固体,采用溶解、蒸发结晶、趁热过滤、冷却结晶的方法
D . 中学实验室中可以将未用完的钠、钾、白磷等丢弃至实验水池进行处理
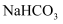 溶液、乙醇溶液(盐酸)
C . 苯、甲苯、甲醛溶液、苯酚溶液(酸性
溶液、乙醇溶液(盐酸)
C . 苯、甲苯、甲醛溶液、苯酚溶液(酸性 溶液)
D . 乙醇、乙酸、乙酸乙酯、葡萄糖溶液(新制
溶液)
D . 乙醇、乙酸、乙酸乙酯、葡萄糖溶液(新制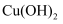 悬浊液)
悬浊液)



