物质的分离、提纯和检验 知识点题库

已知:该实验条件下,各金属离子沉淀的pH如图2所示.下列判断正确的是( )
-
(1) 写出氰化钠遇水产生氰化氢的离子方程式.
-
(2) 爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理.氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式.
-
(3) 爆炸残留在废水中的CN﹣可以用Cr2O72﹣处理,拟定下列流程进行废水处理

1)上述处理废水流程中主要使用的方法是;
a.混 凝法 b.中和法 c.沉淀法 d.氧化还原法
2)②中反应后无气体放出,该反应的离子方程式为;
3)步骤③中,每处理0.4 molCr2O72﹣时转移电子2.4 mol,该反应的离子方程式为;
4)处理酸性Cr2O72﹣废水多采用铁氧磁体法.该法是向废水中加入FeSO4 •7H2O将Cr2O72﹣还原成Cr3+ , 调节pH,Fe、Cr转化成相当于FeⅡ[FexⅡCr(2﹣x)Ⅲ]O4 (铁氧磁体,右上角的罗马数字表示该元素的化合价)的沉淀.处理1 mol Cr2O72﹣ , 需加入amol FeSO4 •7H2O,下列结论正确的是.
A.x=0.5,a=6 B.x=0.5,a=10 C.x=1.5,a=6 D.x=1.5,a=10.

已知碳酸钠的溶解度(S)随温度变化的曲线如图所示:

回答下列问题:
-
(1) 滤渣的主要成分为.
-
(2) “趁热过滤”的原因是.
-
(3) 若在实验室进行“趁热过滤”,可采取的措施是(写出一种).
-
(4) 已知:Na2CO3•10H2O (s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ•mol﹣1
Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H2=+473.63kJ•mol﹣1
写出Na2CO3•H2O脱水反应的热化学方程式.
①加入稍过量的碳酸钠溶液;②加入稍过量的氢氧化钠溶液;③加入稍过量的氯化钡溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是( )
①  、NaOH、
、NaOH、  、HCl ②
、HCl ②  、HCl、
、HCl、  、NaOH
、NaOH
③NaOH、  、
、  、HCl ④
、HCl ④  、
、  、NaOH、HCl
、NaOH、HCl

-
(1) 写出仪器名称:a,b。
-
(2) 从海带提取碘的操作如下,除特殊说明外,请在空白处填上装置中的序号:将干海带进行灼烧,海带灰中含有较多KI,将海带灰溶于水,然后得到澄清滤液;向滤液中加入硫酸和H2O2混合溶液,得到棕褐色含有单质碘的水溶液。该反应的离子方程式为:。向碘的水溶液中加入适量CCl4 , 进行操作将上下两层溶液分开。将含有碘的CCl4溶液置于蒸馏烧瓶内进行操作,可以粗略从CCl4溶液中分离出碘。

-
(1) 步骤③中,为提高反应速率,可用稀HNO3代替O2 , 此时需要严格控制n(HNO3):n(H2SO4)=,用稀HNO3代替O2的不足之处是。
-
(2) 步骤④中,该反应的离子方程式为;实际生产中,步骤④中要适当通入过量SO2 , 原因可能是。
-
(3) 若在实验室中用98%的浓H2SO4配制步骤③所需的稀H2SO4 1000 mL所需的仪器有:。
| 实验目的 | 主要玻璃仪器 | 试剂 | |
| A | 配制100mL,pH=2的盐酸 | 100mL容量瓶、烧杯、玻璃棒、胶头滴管 | pH=1的盐酸、蒸馏水 |
| B | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、NaOH溶液 |
| C | 验证蔗糖水解产生还原性糖 | 试管、烧杯、酒精灯、玻璃棒、玻璃片、胶头滴管 | 蔗糖溶液、稀硫酸、10%NaOH溶液、2%CuSO4溶液、蒸馏水、pH试纸 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol/L盐酸 |
-
(1) 乙烯的电子式,结构简式。
-
(2) 鉴别甲烷和乙烯的试剂是(填序号)。
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
-
(3) 下列物质中,可以通过乙烯加成反应得到的是(填序号)。
a.CH3CH3 b.CH3CHCl2 c.CH3CH2OH d.CH3CH2Br
-
(4) 已知 2CH3CHO+O2
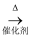 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
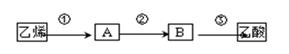
反应②的化学方程式为。 工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为,反应类型是。

 +2H2O采用饱和Ca(OH)2溶液浸杂卤石制备 K2SO4工艺流程如下:
+2H2O采用饱和Ca(OH)2溶液浸杂卤石制备 K2SO4工艺流程如下: 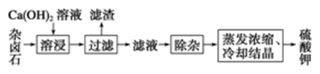
回答下列问题:
-
(1) 滤渣的主要成分有和以及未溶杂卤石。
-
(2) 用化学平衡移动原理解释Ca(OH)2溶液能溶解杂岗石浸出K+的原因
-
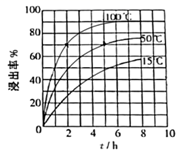
(3) “溶浸”中,K+的浸出率结果如图所示。由图可知,当K+的浸出率为70%时。可以采用的实验条件为
-
(4) “除杂”中,先加入溶液,经搅拌等操作后,过滤,再加入溶液,调滤液pH至中性。
-
(5) 以可溶性碳酸盐为溶浸剂,溶浸过程中会发生: CaSO4(s)+CO
 (ag)⇌CaCO3(s)+ SO
(ag)⇌CaCO3(s)+ SO  (ag)
(ag) 已知298K时,Ksp(CaCO3)=2.80×10-9 , Ksp(CaSO4)=4.90×10-5.此温度下,该反应的平衡常数K=。

-
(1) 能够证明混合气体中含有SO2的实验现象是:;
-
(2) 设计B、C的实验目的是:;
-
(3) 写出B中发生反应的离子方程式:;
-
(4) 能够证明混合气体中含有CO2的实验现象是: 。
-
(5) 若将等体积的SO2和Cl2一起通入水中,写出所发生反应的化学方程式。



