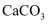几组未知物的检验 知识点题库
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.进行如实验:下列有关说法正确的是( )

固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种.某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:
已知:HCO3﹣+AlO2﹣+H2O═Al (OH)3↓+CO32﹣
下列说法正确的是( )

①把混和气体通过浓H2SO4时,气体体积明显减小.
②再通入过量碱石灰时,体积又明显减小;
③剩余气体接触空气时,立即变为红棕色,可得:
混和气体中一定存在 ,一定不存在 ,可能存在
(1)依次写出D、E、G三种微粒符号 ;
(2)a、d的比值为 ;
(3)复盐的化学式为 (写出计算步骤)
-
(1) 化合物A的化学式为化合物A与H2O反应的离子方程式为:.
-
(2) 化合物A可作为一种“绿色高效多功能”水处理剂,可由FeCl3和KClO在强碱性条件下反应制得,其反应的离子方程式为
-
(3) 化合物A还可以作为高容量电池材料,与MnO2﹣Zn电池类似,A﹣Zn也可以组成碱性电池,A在电池中作为正极材料,其电极反应式为,该电池总反应的离子方程式为.
-
(4) 目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展.下列物质中有可能提高化合物A水溶液稳定性的是A . 醋酸钠 B . 醋酸 C . Fe(NO3)3 D . KOH
-
(5) 请设计一个实验方案,研究温度对化合物A水溶液稳定性的影响:.
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解.
根据上述实验事实,回答下列问题:
原固体混合物中一定含有的物质是,一定不含有的物质是,可能含有的物质是.(写化学式)对可能有的物质,可采用向滤液中滴加溶液的方法来检验.
① | ② | ③ | |
(A) | BaCl2 | HNO3 | Na2SO4 |
(B) | CaCl2 | HNO3 | KCl |
(C) | KCl | H2SO4 | CaCl2 |
(D) | BaCl2 | H2SO4 | CaCl2 |
中的一种或几种.实验步骤如下:
①取少量固体投入水中,既有气体又有沉淀产生.
②过滤,取少量滤液加AgNO3溶液,无沉淀产生.
③再取少量滤液,加入足量NaOH溶液,也无沉淀产生.
-
(1) 推断白色粉末中一定有,一定没有,不能肯定有没有的是.(填序号,选错倒扣分,扣完为止,不出现负分.)
-
(2) 请写出实验步骤①中产生气体的离子方程式:.
-
(3) 请写出实验步骤①中产生沉淀的离子方程式:.

请回答:
-
(1) 过程②中分离C和E的化学实验基本操作是;
-
(2) 溶液H中所含的阳离子有(用离子符号表示);
-
(3) 合金A与D在高温下反应的化学方程式.
(Ⅰ)将混合物溶于水,得到无色透明溶液.
(Ⅱ)取上述溶液分成两份盛于试管中,其中一份滴加BaCl2溶液,产生白色沉淀,再加稀硝酸,沉淀不溶解;另一份滴加NaOH溶液,有白色沉淀生成.
试根据实验现象推断,并完成下面的填空:
-
(1) 该混合物中一定有;一定没有;可能有(写化学式).
-
(2) 若要检测上述可能存在物质,需要做(填写实验名称)
| 选项 | 实验目的 | 实验方案 |
| A | 探究浓度对化学反应速率的影响 | 两支试管中分别盛有 |
| B | 探究蔗糖水解产物的还原性 | 在蔗糖中加入稀硫酸,水浴加热,再加入新制的氢氧化铜悬浊液并加热,观察是否产生红色沉淀 |
| C | 探究浓度对化学平衡的影响 | 向 |
| D | 检验溶液中的 | 向溶液中加入盐酸酸化的氯化钡溶液,观察是否产生白色沉淀 |
 +I2+H2O=
+I2+H2O=  +2I-+2H+ , 某无色溶液中可能含有Fe3+、Na+、K+、Cu2+、H+、
+2I-+2H+ , 某无色溶液中可能含有Fe3+、Na+、K+、Cu2+、H+、  、I-、
、I-、  、
、  中的几种,且所有离子物质的量浓度相等。向溶液中逐滴加入H2O2溶液,刚开始一段时间溶液颜色没有变化,之后变黄色(不考虑盐类水解及水的电离);向反应后的溶液中滴加BaCl2溶液,产生白色沉淀。下列关于该溶液的判断正确的是( )
中的几种,且所有离子物质的量浓度相等。向溶液中逐滴加入H2O2溶液,刚开始一段时间溶液颜色没有变化,之后变黄色(不考虑盐类水解及水的电离);向反应后的溶液中滴加BaCl2溶液,产生白色沉淀。下列关于该溶液的判断正确的是( )
 C . 肯定含有Na+、K+、
C . 肯定含有Na+、K+、  D . 可能含有
D . 可能含有 
 、Mg2+、Cu2+、Cl-、CO
、Mg2+、Cu2+、Cl-、CO 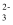 、SO
、SO 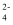 中的几种离子,且各离子物质的量相等。将该固体加足量水完全溶解得到无色溶液X,取溶液X进行如图实验:
中的几种离子,且各离子物质的量相等。将该固体加足量水完全溶解得到无色溶液X,取溶液X进行如图实验: 
下列说法正确的是( )



 ,某同学欲探究该溶液的组成进行了如下实验:
,某同学欲探究该溶液的组成进行了如下实验: Ⅰ.用铂丝醮取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,此时溶液颜色加深,但无沉淀生成
Ⅲ.取Ⅱ反应后溶液分别置于两支试管中,第一支试管中加入 BaCl2 溶液有白色沉淀生成, 再滴加 KSCN 溶液,上层清液变红,第二支试管加入 CCl4 , 充分振荡静置后溶液分层,下层为无色。
下列说法正确的是( )
 B . 原溶液中肯定含有
B . 原溶液中肯定含有  C . 步骤Ⅱ中无色气体是 NO 气体,无 CO2 气体产生
D . 为确定是否含有 Cl-可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
C . 步骤Ⅱ中无色气体是 NO 气体,无 CO2 气体产生
D . 为确定是否含有 Cl-可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
目的 | 方案设计 | 现象和结论 | |
A | 验证 | 取样与适量溴水混合,充分反应,观察现象 | 溴水褪色,说明样品分子中含有碳碳双键 |
B | 检验淀粉水解是否完全 | 将适量样品与稀硫酸反应,加入足量 | 无明显现象,说明淀粉水解完全 |
C | 检验牙膏中的摩擦剂成分 | 取少量牙膏于试管中,加水溶解,滤渣中滴加足量盐酸 | 若滤渣溶解并产生无色气泡,则摩擦剂可能为 |
D | 检验某固体是否为铵盐 | 取样品于试管中,滴加少量 | 若试纸不变蓝色,则固体不是铵盐 |
 和
和  的酸性高锰酸钾溶液,同时各加入
的酸性高锰酸钾溶液,同时各加入  的草酸溶液,观察紫色褪去的快慢
的草酸溶液,观察紫色褪去的快慢 和
和  混合溶液中加入4滴饱和
混合溶液中加入4滴饱和  溶液,观察溶液颜色变化
溶液,观察溶液颜色变化 分子中的碳碳双键
分子中的碳碳双键 溶液后加入碘水,观察现象
溶液后加入碘水,观察现象