几组未知物的检验 知识点题库
( )
①肯定有BaCl2; ②肯定有MgCl2; ③肯定有NaHCO3; ④肯定有Na2CO3或NaHCO3; ⑤肯定没有MgCl2 .
③B+A→溶液+沉淀X,④D+B→溶液Y+沉淀,⑤溶液Y+沉淀X→溶液+气体.
-
(1) 根据以上记录确定:A B C D (填化学式)
-
(2) 写出①、③、⑤各反应的离子方程式:
① ③ ⑤
-
(1) 根据以上记录确定:ABCD(填化学式)
-
(2) 写出①、③、⑤各反应的离子方程式:
①③⑤.
①将固体溶于水,搅拌后得到无色透明溶液;②往此溶液中滴加硝酸钡溶液,有白色沉淀生成;③过滤,将沉淀置于稀硝酸中,发现沉淀全部溶解.
-
(1) 试判断:固体混合物中肯定含有,肯定没有,可能含有.
-
(2) 对可能有的物质,可采用来检验,如果含有该物质,其现象是.
-
(1) 取试样溶于水,得到无色澄清溶液,则此固体粉末中一定没有、.
-
(2) 取上述溶液适量,滴加过量的BaCl2溶液,出现白色沉淀,再加入过量的稀硝酸,沉淀部分消失并产生气泡.则此固体粉末中一定有、.
-
(3) 取步骤(2)实验后的上层清液,加入稀硝酸、硝酸银溶液,出现白色沉淀,由此该同学得出此固体粉末中一定含有NaCl,你认为此结论是否正确(填“是”或“否”).
-
(4) 对于是否含有NaCl,你认为应对步骤(2)作如何改进(若步骤(3)填“是”,此空不作答).

①将固体混合物溶于水,搅拌后得无色透明溶液;
②往此溶液中滴加BaCl2溶液,有白色沉淀生成;
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解.
试判断:
-
(1) 固体混合物中肯定有,肯定没有,可能有.
-
(2) 写出实验③中的离子方程式:.
-
(3) 对可能有的物质进行确认,把③的滤液做进一步鉴别操作,写出你所设计的实验方案(包括具体操作步骤和实验现象).


下列说法正确的是( )
-
(1) 各取适量固体试剂分别加入5支试管中,加入适量蒸馏水,振荡试管,观察则被检出的物质的化学式是
-
(2) 分别取未检出液,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式:
①现象:试管中有白色沉淀生成,离子方程式:;
②现象:试管中有蓝色沉淀生成,离子方程式: ;
-
(3) 最后可利用试剂(填化学式,在已鉴别出的物质中选)鉴别余下未检出的物质.

试根据实验过程和发生的现象填写以下空白:
-
(1) 气体D能使湿润的红色石蕊试纸变为色.
-
(2) 固体H的化学式是.
-
(3) 若要检验溶液F中阴离子的,应先加检验,然后再加合适试剂检验.
-
(4) 根据步骤②你能确定混合物中一定存在.(只写一种,填化学式),你判断的依据是.
-
(5) 若溶液F和溶液I混合后溶液变为黄色并放出气体,则说明原固体中至少有种物质.
⑴将固体混合物溶于水,搅拌后得无色透明溶液;
⑵往此溶液中滴加过量的硝酸钡溶液,有白色沉淀生成;
⑶过滤,将沉淀物置于稀硝酸中,发现沉淀部分溶解.
试判断:
①固体混合物中肯定有,
②肯定没有,
③可能有;
对可能有的物质,可采取向滤液中滴加溶液的方法来检验.
-
(1) 选用如图所示装置及药品制取CO2。打开弹簧夹,制取CO2。为了得到干燥、纯净的CO2 , 产生的气流应依次通过盛有、的洗气瓶(填试剂名称)。反应结束后,关闭弹簧夹,可观察到的现象是。不能用稀硫酸代替稀盐酸,其原因是。

-
(2) 金属钠与二氧化碳反应的实验步骤及现象如下表:
步骤
现象
将一小块金属钠在燃烧匙中点燃,迅速伸入盛有CO2的集气瓶中。充分反应,放置冷却
产生大量白烟,集气瓶底部有黑色固体产生,瓶壁上有白色物质产生
在集气瓶中加入适量蒸馏水,振荡、过滤
滤纸上留下黑色固体,滤液为无色溶液
①为检验集气瓶瓶壁上白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红:向第二支试管中滴加澄清石灰水,溶液变浑浊。据此推断,白色物质的主要成分是(填标号)。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
②为检验黑色固体的成分,将其与浓硫酸反应,生成的气体具有刺激性气味。据此推断黑色固体是。
③本实验中金属钠与二氧化碳反应的化学方程式为。

| 实验操作 | 实验现象 | 实验结论 | |
| A | 适量二氧化碳通入氯化钡溶液中 | 产生白色沉淀 | 碳酸的酸性比盐酸弱 |
| B | 二氧化硫通入溴水中 | 溶液褪色 | 二氧化硫有漂白性 |
| C | 取少量某无色溶液,先滴加氯水,再加入少量四氯化碳,振荡、静置 | 溶液分层,下层呈橙红色 | 原无色溶液中一定有溴离子 |
| D | 淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 | 产生红色沉淀 | 淀粉水解可生成葡萄糖 |
 是一种性能优异的白色颜料,由钛铁矿(主要成分为
是一种性能优异的白色颜料,由钛铁矿(主要成分为 , 杂质为镁、钡、铝等化合物)制取
, 杂质为镁、钡、铝等化合物)制取 (包括测定纯度)和绿矾晶体,实验流程如下。
(包括测定纯度)和绿矾晶体,实验流程如下。
已知:⑴ 。
。
⑵ 遇
遇 溶液显橙黄色。
溶液显橙黄色。
⑶ 。
。
请回答:
-
(1) 若步骤I中不控制温度,反应开始一会后就会过于剧烈,推测原因是。
-
(2) 步骤Ⅲ加入适量铁粉的目的是。
-
(3) 步骤Ⅳ:下列说法正确的是____。A . 滤液2经蒸发结晶、趁热过滤、洗涤、干燥可得副产品绿矾 B . 将滤液2迅速置于冰—盐浴中冷却,有利于析出大颗粒绿矾晶体 C . 过滤绿矾晶体时,宜采用玻璃砂芯漏斗 D . 先用适量稀硫酸洗涤绿矾晶体并将洗出液与滤液3合并,可提高二氧化钛收率
-
(4) 步骤V:为了实现高酸度条件下
 的水解,先取约
的水解,先取约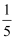 体积滤液3,并在不断搅拌下逐滴加到约为滤液总体积
体积滤液3,并在不断搅拌下逐滴加到约为滤液总体积 倍的沸水中,继续煮沸约
倍的沸水中,继续煮沸约 后,再慢慢加入其余全部滤液,这样操作的目的是。
后,再慢慢加入其余全部滤液,这样操作的目的是。
-
(5) 测定
 的纯度:将粗产品溶于强酸,还原为
的纯度:将粗产品溶于强酸,还原为 制得待测液,然后用
制得待测液,然后用 标准溶液进行滴定。
标准溶液进行滴定。①给出配制
 标准溶液并进行滴定的操作排序:( )→( )→( )→( )→量取待测液、标准液→加指示剂→滴定
标准溶液并进行滴定的操作排序:( )→( )→( )→( )→量取待测液、标准液→加指示剂→滴定a.称取所需质量的六水氯化铁晶体 b.加适量水溶解
c.将晶体在
 气流中加热脱水 d.溶于浓盐酸
气流中加热脱水 d.溶于浓盐酸e.加水稀释 f.定容至标准浓度
②滴定
 时选择的指示剂是。
时选择的指示剂是。A.
 B.
B. C.甲基橙
C.甲基橙③实验测得
 的纯度偏低,则产品中可能含有的杂质是。
的纯度偏低,则产品中可能含有的杂质是。



