几组未知物的检验 知识点题库
①将过量的稀盐酸加入铝灰中,充分反应后过滤得到溶液甲和固体乙
②取少量溶液甲滴加AgNO3溶液,生成白色沉淀
③取少量溶液甲分成两等份,向其中一份滴加K3[Fe(CN)6]溶液,产生蓝色沉淀;向另一份滴加KSCN溶液,溶液变成血红色
④取少量溶液甲加入过量NaOH溶液,并置于空气中.充分反应后经过滤、洗涤、灼烧得到1.60g固体丙,将固体丙置于氢气流中加热充分反应后得到1.12g固体丁
根据以上实验现象或数据,该同学得出的结论正确的是( )
实验室有一包由两种盐(不含氢元素)组成的白色粉末和一瓶标签破损的未知酸溶液.为了确定各自成分,某同学设计了如图实验:

已知,气体A是绿色植物光合作用的原料,固体B是农业上常用的由两种元素组成的钾肥.则:气体A是 ;未知酸溶液是 ;组成白色粉末的两种盐是 和
-
(1) 甲的化学式为
-
(2) 生成气体丙的物质的量为 mol;
-
(3) 乙中阳离子的电子式为 ,检验乙中阳离子的常用实验方法为
-
(4) 写出一个用化合反应生成丁的离子方程式 ;举例说明盐丁的一种用途
-
(5) 价电子数(主族元素就是最外层电子数)和原子数相同的分子、离子或原子团互称为等电子体.与丙互为等电子体的是
A.CS2 B.O3 C.SO2 D.SCN﹣ .
①取少量固体粉末加到足量水中,得到无色溶液;
②取①中溶液少量继续往其中加入足量稀硫酸,有气泡产生;
③继续向②中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成;
④取①中溶液少量,加入NaOH溶液并加热,产生刺激性气味的气体,并用湿润的红色石蕊试纸检验气体,试纸变蓝.
根据以上事实判断:
-
(1) 肯定存在的是;
-
(2) 肯定不存在的是;
-
(3) 不能确定是否存在的是.请简述证明该物质是否存在的实验方案(实验方法、现象、结论).
-
(4) 写出上述实验④中产生刺激性气味气体反应的化学方程式:.

-
(1) 试通过计算确定该结晶水合物的化学式为;
-
(2) 假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0mol•L﹣1 .
①加入少量Ba(OH)2溶液,则反应的离子方程式为;
②加入一定量的Ba(OH)2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为 ;
③若加入75mL的Ba(OH)2溶液,则得到的沉淀质量为 .
-
(1) 写出有关物质的化学式:AB、 C、 E
-
(2) 写出F和H反应的化学方程式.
-
(3) 写出下列反应的离子方程式:①D+盐酸②B+水.

回答下列问题:
-
(1) 溶液中一定含有的溶质是,一定不含有的溶质是(填化学式).
-
(2) 溶液中可能含有的溶质是(填名称),判断该物质是否存在的实验方法是,现象是.
-
(3) 分别写出AB段、BC段发生反应的离子方程式:
①AB段为;②BC段为.
检测次数 | 溶液中检测出的物质 |
第一次 | KCl、K2SO4、Na2CO3、NaCl |
第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
第三次 | Na2SO4、KCl、K2CO3、NaCl |
-
(1) 三次检测结果中第次检测结果不正确.
-
(2) 在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子(提示:Ag2sO4微溶于水):
第一步:向溶液中滴加过量的溶液(填化学式),其目的是检验CO32﹣ . 并将其除去;发生反应的离子方程式为.
第二步:加入过量的溶液(填化学式),其目的是;
第三步:过滤,再向滤液中加入溶液(填化学式),发生反应的离子方程式.
① 一份溶液中加入足量BaCl2溶液,得沉淀2.33 g,在沉淀中加入过量稀盐酸,沉淀不溶解。
②另一份溶液中加入足量NaOH溶液,得蓝色絮状沉淀19.6 g。
-
(1) 通过步骤①可以推断出,溶液中一定没有的离子是;
-
(2) 根据上述实验,该溶液中可能有的离子是;
-
(3) 向②中的沉淀中加稀醋酸,写出该离子反应方程式。

-
(1) I.碳酸亚铁的制备(装置如下图所示)
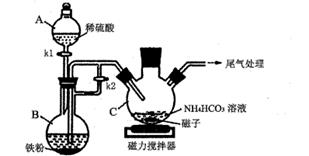
仪器B的名称是;实验操作如下:打开kl、k2 , 加入适量稀硫酸,关闭kl , 使反应进行一段时间,其目的是。
-
(2) 接下来要使仪器C中的制备反应发生,需要进行的操作是,其反应的离子方程式为。
-
(3) 仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是。
-
(4) Ⅱ.乳酸亚铁的制各及铁元素含量测定
向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
-
(5) 两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是 。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24. 80 mL,则样品纯度为%(保留1位小数)。
 B . 气体通过无水CuSO4 , 粉末变蓝,证明原气体中含有水蒸气
C . 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+ , 无K+
D . 某溶液加入AgNO3后产生白色沉淀,证明原溶液中有Cl-
B . 气体通过无水CuSO4 , 粉末变蓝,证明原气体中含有水蒸气
C . 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+ , 无K+
D . 某溶液加入AgNO3后产生白色沉淀,证明原溶液中有Cl-
|
步骤和现象 |
现象 |
|
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合,过滤,得滤液X和白色沉淀Y |
|
|
Ⅱ.向滤液X 中滴加几滴饱和KI溶液 |
生成黄色沉淀M |
|
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 |
沉淀Y 转化为黑色沉淀Z |
|
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 |
沉淀Y逐渐溶解 |
-
(1) 由步骤Ⅱ的现象可推测,滤液 X 中除了含有Na+、NO3- , 还含有的离子有。
-
(2) 写出步骤Ⅲ中生成黑色沉淀 Z 的离子方程式为,白色沉淀Y 转化为黑色沉淀 Z 的主要原因是。
-
(3) 已知:Ag+ + 2NH3· H2O⇌Ag(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因。
-
(4) 为了进一步探究银的难溶化合物沉淀溶解的多样性,该同学又做了如下对比实验 V:
①取少量黑色沉淀 Z 和黄色沉淀 M,分置于两支试管中
②然后分别滴加同体积同浓度的稀硝酸,观察到黄色沉淀 M 不溶解,黑色沉淀 Z 溶解,并且有无色气体产生。综合实验Ⅱ至实验 V 的信息,下列预测正确的是__________
A . 黑色沉淀 Z 比黄色沉淀 M 更难溶于水 B . 黑色沉淀 Z 溶解于稀硝酸是因为发生了氧化还原反应 C . 由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管 D . 在步骤Ⅳ之后,继续滴加浓硝酸后又有 AgCl 沉淀生成
 、
、  、
、  、
、  、
、  、
、  、
、  ,现取三份
,现取三份 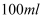 溶液进行如下实验:
溶液进行如下实验: ①第一份加入 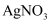 溶液有沉淀产生
溶液有沉淀产生
②第二份加足量  溶液加热后,收集到气体
溶液加热后,收集到气体 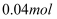
③第三份加足量  溶液后,得干燥沉淀
溶液后,得干燥沉淀 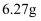 ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为  .根据上述实验,以下推测正确的是( )
.根据上述实验,以下推测正确的是( )
 一定存在
B .
一定存在
B . 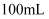 溶液中含
溶液中含  C . Cl-一定存在
D .
C . Cl-一定存在
D .  一定不存在,
一定不存在,  可能存在
可能存在
| 选项 | 实验操作和现象 | 结论 |
| A | 用铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 该溶液中可能含有 |
| B | 取少量溶液 | 该溶液中含有 |
| C | 取少量金属 | 该白色固体为 |
| D | 将金属 | 说明 |
 B . 将饱和NaBr溶液滴入AgCl浊液中,沉淀颜色由白色变为淡黄色,证明
B . 将饱和NaBr溶液滴入AgCl浊液中,沉淀颜色由白色变为淡黄色,证明 C . 常温下,用pH试纸分别测定浓度均为
C . 常温下,用pH试纸分别测定浓度均为 溶液和
溶液和 溶液,后者pH大,证明酸性:
溶液,后者pH大,证明酸性: D . 将同浓度同体积的
D . 将同浓度同体积的 溶液与
溶液与 溶液混合,充分反应后滴入KSCN溶液,溶液变红色,证明该反应存在一定限度
溶液混合,充分反应后滴入KSCN溶液,溶液变红色,证明该反应存在一定限度

 加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色无味气体
加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色无味气体
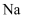 放在坩埚中灼烧,产生白色固体
放在坩埚中灼烧,产生白色固体
 活泼
活泼


