过滤的原理、方法、操作及其应用 知识点题库
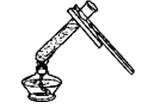
从自然界中获得的粗盐,含有较多的杂质,需要精制。为了除去粗盐中泥沙等不溶性杂质设计了如图A、B、C三个步骤。

-
(1) B步骤称为。
-
(2) C步骤中,当蒸发皿内出现较多固体时,应该(填字母)。
A.移去酒精灯,停止搅拌 B.移去酒精灯,用玻璃棒继续搅拌 C. 继续加热蒸干水分,再移去酒精灯
人类是生活离不开水,某生活污水主要含有碎菜叶、碎塑料薄膜、泥沙、氯化钠和碳酸钠等物质.现欲将其经去渣处理后作为清洗厕所的用水.请问:

(1)捡掉污水中的碎菜叶、碎塑料薄膜等较大的固体后,可对污水进行操作除去其中捡不掉的固体物质;把生活污水进行处理在利用的目的是;
(2)①试剂A的化学式是 ,试剂A加入过量的作用是;
②写出步骤Ⅱ所发生反应的化学方程式 ;如果步骤Ⅰ先加入试剂B,步骤Ⅱ加入过量试剂A,也能达到检验氯化钠的目的,理由是.

B . 倾倒液体
B . 倾倒液体
C . 用固体
C . 用固体
D . 过滤粗盐水
D . 过滤粗盐水
(1)为防止旅途中皮肤意外擦伤后感染,常备碘酒.碘酒中的溶剂是(写物质名称).
(2)有时遇到蚊虫叮咬,蚊虫会分泌一些酸性物质使皮肤奇痒难忍.你认为可选用下列 来涂抹止痒.(填序号)
A.食醋(含醋酸) B.氢氧化钠 C.食盐水 D.牙膏或肥皂水
(3)户外取泉水,往往用干净的棉纱口罩罩住水杯口,再经过口罩将水倒入储水罐备用.这个操作属于物质分离中的(填操作名称).
(4)旅途中会产生一些生活垃圾,提倡分类处理.下列垃圾应放入金属类垃圾箱的是 ;应放入塑料类垃圾箱的是 (填序号).
A.矿泉水瓶 B.铝制易拉罐 C.瓜果皮 D.纸质参观券
(5)景区常见“珍珠粉”(主要成分是CaCO3)作为名贵中药材和保健品出售.请写出它与盐酸反应的化学方程式: .
①含泥沙的精盐
②浑浊的河水
③含有沙子的大米
④食盐和白糖.


操作①的名称是,操作②应选用的装置是下图中的(填序号);其中净化程度最高的装置是图中的(填序号)
 B . 稀释浓硫酸
B . 稀释浓硫酸  C . 过滤
C . 过滤 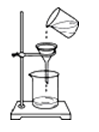 D . 测定溶液pH
D . 测定溶液pH 

请回答相关问题:
-
(1) 在制备精盐的过程中,在滤液中加入适量盐酸的目的是。
-
(2) 在盐卤制镁的过程中,加入了生石灰,由生石灰变成Mg(OH)2的化学方程式为、;操作I的名称叫,若发现滤液有少量浑浊出现,你认为可能的原因是。
-
(3) 在盐卤制镁的过程中,加入了生石灰,由生石灰变成Mg(OH)2的化学方程式为、;操作I的名称叫,若发现滤液有少量浑浊出现,你认为可能的原因是。
-
(4) 在盐卤制镁的过程中,加入B物质的名称是,请写出MgCl2·6H2O分解生成MgCl2的化学方程式为。

-
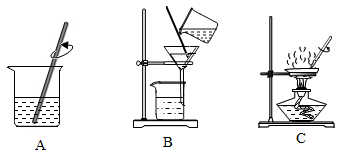
(1) 过滤操作中除了需带铁圈的铁架台、滤纸、烧杯外,还需要用到的仪器有。
-
(2) 试剂x的名称是。
-
(3) 蒸发过程中,观察到时,就可熄灭酒精灯。
-
(1) 甘蔗在压榨过程中发生的变化属于。
-
(2) 渣汁的分离与图中的(选填“A”、“B”或“C”)实验原理相同。
-
(3) 糖汁在蒸发浓缩过程中,溶液的溶质质量分数将怎么变化?
 2CuSO4+2H2O)
2CuSO4+2H2O) 
-
(1) 操作①的名称是,写出滤液②中金属阳离子符号:。
-
(2) 写出滤液③和铁粉发生反应的一个化学方程式:。
-
(3) 写出固体A的成分:,Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是。
-
(4) 回收过程中需要过量铁粉,滤液①中加入过量铁粉的目的是,工业上高炉炼铁的原理是(用化学方程式表示),铁锭可以轧成铁板,体现了金属的性。

【已知:Fe+Fe2(SO4)3=3FeSO4;SiO2不溶于水,也不与稀硫酸反应】
-
(1) 操作①的名称是。
-
(2) 溶液A中的溶质除H2SO4外,还存在。
-
(3) 上述流程中生成固体c的化学方程式。

![]()
-
(1) 在步骤A中,加入明矾以形成黏性絮状物,泥沙、细菌和其他微粒都黏附到明矾上,明矾因此被称为 。这种使水中的杂质沉淀到水底的方法称为。
-
(2) 能消毒杀菌的步骤是。
-
(3) 步骤C称为。
-
(4) 经过步骤A、B、C、D得到的自来水属于(选填“纯净物"或"混合物")。

-
(1) 操作①是加水充分溶解,操作②的名称是 。
-
(2) 沉淀B的化学式是。
-
(3) 小科根据实验现象认为样品中定含有氢氧化钠, 同学们都认为小科的判断是不正确,其理由是。
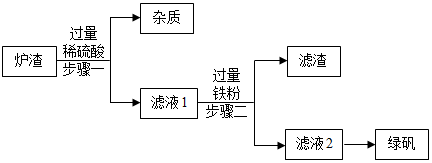
查阅资料:氧化亚铁与稀硫酸、铁与硫酸铁反应均可生成硫酸亚铁。
-
(1) 步骤一中的操作名称是。
-
(2) 步骤一中,写出其中反应的化学方程式为。
-
(3) 将滤液2蒸发浓缩、降温结晶、过滤,冰水洗涤,低温干燥后得到FeSO4·7H2O晶体,其中冰水洗涤的作用是。
-
(4) pH大小关系:滤液1<滤液2,造成该结果的原因是。
|
溶液份数 |
第1份 |
第2份 |
第3份 |
第4份 |
|
蒸发水的质量/g |
10 |
20 |
30 |
40 |
|
杯底固体A的质量/g |
0 |
1 |
3 |
5 |
-
(1) 把杯底固体A分离出来的操作是。
-
(2) 在20℃时,第1份溶液蒸发后的剩余溶液 (填“是”“不是”或“可能是”)A的饱和溶液。



