含杂质物质的化学反应的有关计算 知识点题库
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 4.24 | 4.16 | 4.08 | 4.08 |
试计算:
-
(1) 完全反应后产生的氧气的总质量为.
-
(2) 样品氯酸钾纯度是多少?
实验步骤 | ①称取烧杯的质量 | ②将适量盐酸加入烧杯中并称重 | ③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | ④待反应完全后,称重 |
实验图示 |
| |||
实验数据 | 烧杯的质量为50.0g | 烧杯和盐酸的质量为100.0g | 石灰石样品样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
试通过分析计算:
-
(1) 该实验中生成的二氧化碳的质量是多少克?
-
(2) 该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)
-
(1) 汉代海昏侯国遗址考古发掘出大量珍贵文物.下列文物中,由金属材料制成的是(填字母).

-
(2) 欲通过实验验证铝、铜、银的金属活动性顺序,可选用的一组药品是铝、硫酸铜溶液和银,发生反应的化学方程式为;还可选用的一组药品是溶液、铜和硝酸银溶液,发生反应的化学方程式为.
-
(3) 用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
( 利用化学方程式进行计算,写出计算过程,结果精确到0.1 t)
废铁粉中Fe2O3含量大约在80%(其余20%为铁),工业上常用一氧化碳将其还原,反应的化学方程式为,若回收100 t这样的废铁粉可以得到t铁。

-
(1) .分别写出硬质玻璃管内产生的现象反应的化学方程式
-
(2) 实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸。检验装置中的空气已排尽的方法是。
-
(3) 高炉炼铁中,焦炭的两个作用是(用化学方程式表示)。
-
(4) 用含氧化铁80%的赤铁矿200t,可炼制含杂质2%的生铁吨
-
(5) 某合金6 g与足量的稀硫酸充分反应后,如果生成0.2 g氢气,该合金中的金属可能是A . Zn 和Fe B . Cu和Ag C . Zn和Cu D . Mg 和Al
-
(1) 40 g铜锌合金中锌的质量是多少g 。
-
(2) 计算所用稀硫酸中溶质的质量分数为多少。
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
|
|
溶解度 |
氯化钠 |
35.7 |
35.8 |
35.9 |
36.1 |
37.1 |
|
碳酸钠 |
7.0 |
12.5 |
21.5 |
39.7 |
49.0 |
|
-
(1) 请据图表简要解释“冬天捞碱,夏天晒盐”其中的道理。
-
(2) 小勤同学取该湖盐样品进行探究。
(提出问题)该湖盐样品的成分是什么?
(猜想与假设)猜想一:只有Na2CO3:猜想二:只有NaCl;猜想三:Na2CO3和NaCl。
(实验探究)
实验操作
实验现象
实验结论
取少量样品于试管中,向其中加入足量的溶液;过滤,得沉淀和滤液,向沉淀中加入足量稀硝酸
产生白色沉淀
部分白色沉淀消失
猜想三成立
-
(3) (拓展延伸)为进一步确定该湖盐样品中Na2CO3的质量分数,小勤同学再取该湖盐样品10.00g做了如图所示的补充实验(假定每步均完全反应或吸收)。

①反应结束之后通入足量空气的目的是。
②装置A中氢氧化钠溶液的作用是(用化学方程式表示)。
③实验结束后测得装置E增重0.44g,请根据图所示的实验过程和提供的数据计算该湖盐样品中碳酸钠的质量分数是?(写出计算步骤,计算结果精确到0.1%)
①生成二氧化碳克。
②石灰石中碳酸钙的质量分数?

-
(1) 上述实验过程中发生反应的化学方程式为。
-
(2) 根据已知条件列出求解第一次所加的稀盐酸中溶质的质量(x)的比例式。
-
(3) 此大理石样品中钙元素的质量分数。
-
(4) 若向反应后的滤液中加10.8g水,所得溶液中溶质的质量分数为。
-
(5) 现有上述大理石样品750t,可以制得含杂质的生石灰的质量为。
-
(1) 合金中金属锌的质量。
-
(2) 该黄铜样品中铜的质量分数
|
实验次数 |
加入稀盐酸的质量/g |
剩余固体的质量/g |
|
1 |
20 |
16 |
|
2 |
20 |
12 |
|
3 |
20 |
10 |
|
4 |
20 |
n |
-
(1) 表中n的数值为。
-
(2) 样品中碳酸钙的质量分数是。
-
(3) 求生成二氧化碳的质量。
-
(1) 在“国庆70周年”阅兵式上展示了一大批具有自主知识产权的新式武器,它们广泛地使用合金而不用纯金属的原因是什么?(一条即可)
-
(2) 驿城区老河乡盛产香菇,青少年食用香菇可以补充生长发育过程所需的“铁”,“铁”指的是(填“原子”、“离子”、“元素”)。
-
(3) 近年流行的“自热火锅”给人们生活带来方便。“自热火锅”主要由食物和发热包(主要成分为生石灰、焙烧硅藻土、活性炭、铁粉、碳酸钠等)组成。

①生石灰用作发热剂,用化学方程式表示发热原理。
②铁粉常用作发热剂,它可以与氧气和水反应最终生成氢氧化铁,写出该化学方程式:。
-
(4) 下图为某同学在实验室模拟工业上炼铁的原理。补充资料:I、已知Fe
 O
O  在一定条件下能逐步失去其中的氧,依次生成Fe
在一定条件下能逐步失去其中的氧,依次生成Fe  O
O 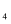 、FeO最终被还原为铁;Ⅱ、酒精灯火焰温度为450℃-650℃;Ⅲ。通过数字化设备对氧化铁和一氧化碳进行分析,获得相关数据并绘制成图。
、FeO最终被还原为铁;Ⅱ、酒精灯火焰温度为450℃-650℃;Ⅲ。通过数字化设备对氧化铁和一氧化碳进行分析,获得相关数据并绘制成图。 
①你认为该实验应进行哪些改进:。
②某同学将反应所得的黑色固体物质放入足量的稀硫酸中,发现生成物中没有铁,得此结论依据的现象是。
③根据资料分析实验失败的原因。
-
(5) 上述实验改进后,用50g含氧化铁80%的赤铁矿石,理论上生成铁的质量是?使用化学方程式计算。
参加反应的一氧化碳的质量。理论上可日产含Fe98%的生铁的质量。
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 稀盐酸的用量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固体的质量/g | 1.5 | 1.0 | 0.5 | 0.3 |
已知石灰石中的杂质既不与盐酸反应,也不溶解于水。下列说法错误的是( )

-
(1) 《千里江山图》流传千年依旧色彩艳丽,璀璨夺目,与所用矿石颜料有关。说明所用矿石颜料化学性质(填“稳定”或“不稳定”):
-
(2) 矿石颜料之一赭石(主要成分为Fe2O3)属赤铁矿,我国早在春秋战国时就开始炼铁。用赤铁矿炼铁的主要反应原理是(用化学方程式表示):
-
(3) 实验室可用如图所示的装置进行模拟炼铁。

反应前大玻璃管中加入铁的氧化物(FexOy)试样的质量为12.6g。加热前,应先往大玻璃管中通入CO气体的原因是。实验结束后,继续通入CO气体,直至大玻璃管冷却。此时NaOH溶液的质量增加了7.7g。推算该铁的氧化物的化学式中x、y的比为(填最简整数比)。




