溶质的质量分数及相关计算 知识点
溶质的质量分数及相关计算
对特定条件下的饱和溶液来说,不论溶液的总量是多少,溶质的质量分数一直为
值得注意的是:①溶质的质量分数只表示溶质质量与溶液质量之比,并不代表具体的溶液质量和溶质质量。
②溶质的质量分数是比值,没有单位;一般用百分数表示。
③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。
④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
⑤当计算饱和溶液中溶质的质量分数(即该温度下该溶质质量分数的最大值)时,才可以使用特殊计算公式来计算。
对特定条件下的饱和溶液来说,不论溶液的总量是多少,溶质的质量分数一直为
值得注意的是:①溶质的质量分数只表示溶质质量与溶液质量之比,并不代表具体的溶液质量和溶质质量。
②溶质的质量分数是比值,没有单位;一般用百分数表示。
③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。
④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
⑤当计算饱和溶液中溶质的质量分数(即该温度下该溶质质量分数的最大值)时,才可以使用特殊计算公式来计算。
溶质的质量分数及相关计算 知识点题库
下列说法正确的是( )
A . 催化剂改变反应速率,但不能增加产量
B . 在20℃的NaCl饱和溶液中加入少量KCl使其溶解,则NaCl质量分数不变
C . 滴加酚酞溶液后不变色的溶液其pH一定等于7
D . 肥皂水可以软化硬水
在冬天气温为5℃时配制的氢氧化钙饱和溶液,在夏天气温为38℃时(水的蒸发忽略不计),不可能出现的情况是

A . 溶液变浑浊
B . 溶液变为不饱和
C . 溶液质量变小
D . 溶质质量分数变小
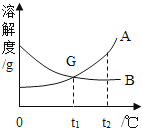
A、B两种固体物质的溶解度曲线如图所示,请根据曲线图回答下列问题.
(1)现有常温下B的不饱和溶液,在只要求保持其中溶剂质量不变的条件下,将其变成饱和溶液,可行的方法有 .
(2)现有一杯t1℃时含A、B两种物质且均饱和的混合溶液,若要从中分离出少量A的纯净物,其操作方法是 .
(3)下列说法正确的是 .
①t2℃时,A的溶液中溶质的质量分数一定比B的溶液中溶质的质量分数大;
②将t2℃A、B的饱和溶液分别降温至t1℃,此时两溶液中的质量分数相等;
③在t1℃时,用两份等量的水分别配制成A、B的饱和溶液,这两种溶液的质量相等;
④在t2℃时,用等量的A、B分别配制成两种饱和溶液,测得其质量依次为m1g和m2g,则m1<m2 .
下图是a、b、c三种物质的溶解度曲线,根据图象回答下列问题:

-
(1) P点的含义是.
-
(2) t2℃时30ga物质加入到50g水中不断搅拌,能形成 g溶液.
-
(3) t2℃时a、b、c三种物质的溶解度按由大到小的顺序排列是(填写物质序号).
-
(4) 相同质量的a、b、c三种物质t2℃时的饱和溶液降温到t1℃时,析出晶体较多的是,没有晶体析出的是.
-
(5) 将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大到小关系是(填写物质序号).
-
(6) M,N两点均表示a物质的溶液,下列做法不能实现M,N间的相互转化的是A . 从N→M:先向N中加入适量的固体a再降温 B . 从N→M:先将N降温再加入适量固体a C . 从M→N:先将M降温再将其升温 D . 从M→N:先将M升温再将其蒸发掉部分水.
将40℃KNO3的饱和溶液降温到20℃,下列说法正确的是( )
A . 溶质的质量不变
B . 溶质的质量分数减小
C . 溶液变为不饱和溶液
D . 溶质的质量分数不变
某化学兴趣小组同学对某铜锌合金样品进行探究实验,称取样品10.0克放入烧杯中,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.

求:
-
(1) 铜锌合金中,Zn的质量分数是多少?
-
(2) 反应后溶液中溶质的质量分数是多少?
请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:

-
(1) 实验过程中产生的CO2气体的质量为g
-
(2) 计算CaCO3中各元素的质量比.
-
(3) 计算反应后的CaCl2 不饱和溶液中溶质的质量分数(写出计算过程,结果精确到0.1%).
实验室有一瓶未知浓度的盐酸,小华为测定该盐酸中溶质的质量分数,取10g溶质的质量分数为16%的氢氧化钠溶液,逐滴滴加该盐酸至恰好完全反应,共消耗盐酸20g,请计算:
-
(1) 10g氢氧化钠溶液中溶质的质量为g。
-
(2) 该盐酸中溶质的质量分数。
下列四个图像的变化趋势,能正确描述对应操作的是( )
A .  向一定量的氢氧化钠溶液中不断地滴加水
B .
向一定量的氢氧化钠溶液中不断地滴加水
B . 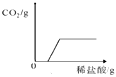 向一定量久置于空气中的氢氧化钠固体中不断地滴加稀盐酸
C .
向一定量久置于空气中的氢氧化钠固体中不断地滴加稀盐酸
C .  向等质量的锌、铁颗粒中分别滴加足量相同浓度的稀盐酸
D .
向等质量的锌、铁颗粒中分别滴加足量相同浓度的稀盐酸
D .  向t℃一定量饱和硝酸钾溶液中不断加入硝酸钾固体
向t℃一定量饱和硝酸钾溶液中不断加入硝酸钾固体
 向一定量的氢氧化钠溶液中不断地滴加水
B .
向一定量的氢氧化钠溶液中不断地滴加水
B .  向一定量久置于空气中的氢氧化钠固体中不断地滴加稀盐酸
C .
向一定量久置于空气中的氢氧化钠固体中不断地滴加稀盐酸
C .  向等质量的锌、铁颗粒中分别滴加足量相同浓度的稀盐酸
D .
向等质量的锌、铁颗粒中分别滴加足量相同浓度的稀盐酸
D .  向t℃一定量饱和硝酸钾溶液中不断加入硝酸钾固体
向t℃一定量饱和硝酸钾溶液中不断加入硝酸钾固体
如图为 NaCl、KNO3、NaNO3 的溶解度曲线。

-
(1) 氯 化 钠 溶 液 中 含 有 少 量 硝 酸 钾 杂 质 , 提 纯 的 方 法 是。
-
(2) 要使 30℃时接近饱和的NaNO3 溶液变成该温度下的饱和溶液,可采用的一种方法是。
-
(3) 若将 50℃时NaCl、KNO3 两种物质的饱和溶液冷却至20℃,该过程中保持不变的是______(填序号)A . 溶质的质量 B . 溶剂的质量 C . 溶质的质量分数 D . 物质的溶解度
-
(4) 60℃时,对 100g 硝酸钾饱和溶液(如 A 烧杯)进行如下操作,请回答相关问题: 所述溶液中所含溶质的质量 DE(填 “>”或“<”或“=”,下同),溶液 A、B、C、E 中溶质质量分数的大小关系是。

-
(5) 如图所示,小烧杯中盛放的是硝酸钾的饱和溶液,若将少量的下列物质分别放入大烧杯中的水中,不断搅拌,则小烧杯中一定有硝酸 钾晶体析出的是________(填字母)。
 A . 硝酸铵 B . 氢氧化钠 C . 冰 D . 浓硫酸
A . 硝酸铵 B . 氢氧化钠 C . 冰 D . 浓硫酸
现有某锌铝合金(Zn-Al)样品8.3g,将其放入200g稀硫酸中,经测定恰好完全反应,蒸发结晶,称量所得固体质量为27.5g,则所用稀硫酸的溶质质量分数为( )。
A . 6.26%
B . 9.8%
C . 19.6%
D . 22.6%
向100g质量分数为3.65%的盐酸中逐滴加入4%的氢氧化钠溶液,同时测定有关数据,下列图像正确的是(横坐标为每次加入氢氧化钠溶液的量)()
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀盐酸,测得反应放出气体的总质量与所加入稀盐酸的质量关系曲线如图所示,请回答:

-
(1) 当加入212g稀盐酸时,放出气体的质量为g。
-
(2) 碳酸钠样品中碳酸钠的质量分数为多少?(写出计算过程)
-
(3) 加入106g稀盐酸(即A点)时烧杯中溶液的溶质质量分数为多少?(写出计算过程)
如图是a、b、c三种物质的溶解度曲线,回答下列问题:

-
(1) P点的含义是。
-
(2) t2℃时,将50克a物质加入到100克水中,充分溶解后,所得溶液的质量是克。
-
(3) 若a中含有少量b,可用的方法提纯a(选填“蒸发结晶”或“降温结晶”);
-
(4) t2℃时,等质量a、b、c三种物质的饱和溶液中溶剂质量由大到小的顺序为。
甲、乙两种物质的溶解度曲线如图所示。下列叙述正确的是( )
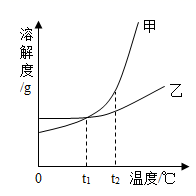
A . 依据溶解度曲线可判断,甲的溶解度比乙的大
B . 将甲、乙的饱和溶液从t2℃降到t1℃,析出乙的质量大
C . 将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法
D . t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等
如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
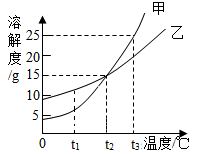
A . 甲中含有少量乙,可用冷却热饱和溶液的方法提纯甲
B . t3℃时,甲的溶液溶质质量分数不一定大于乙的溶液溶质质量分数
C . t1℃时,乙的不饱和溶液通过蒸发溶剂的方法可以转变成饱和溶液
D . t3℃时,将等质量的甲、乙两种物质的溶液分别降温至t2℃,析出晶体的质量甲一定大于乙
硝酸钾、氯化钾的溶解度曲线如图1所示。

-
(1) P点的含义是。
-
(2) 当氯化钾中混有少量硝酸钾时,可用方法提纯氯化钾。
-
(3) t2℃时,分别将30g硝酸钾和氯化钾加入到50g水中,充分溶解后一定形成饱和溶液的是,其溶液的溶质质量分数为(结果精确到0.1%)。
-
(4) 图2是有关硝酸钾溶液的实验操作及变化情况。若保持溶液的质量不变,操作Ⅰ为。
-
(5) 下列有关说法错误的是___________。A . ①与②的溶质质量可能相等 B . ②与③的溶质质量分数一定相等 C . 等温度、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾 D . 等温度、等质量的硝酸钾和氯化钾饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
请你用相关化学知识解释∶
-
(1) 我们在炎热的夏天喝可乐(含有CO2气体的饮料)后,常出现"打嗝"现象,是因为气们的溶解度随温度的升高而(填"增大"或"减小");
-
(2) "××雪饼"包装袋内干燥剂的主要成分是生石灰(化学式CaO),请解释生石灰能做干燥剂的理由是(用化学方程式表示)
-
(3) 医用紫药水是溶质质量分数为0.1%的KMnO4 溶液,若配制200g紫药水,需称量KMnO4固体质量克。
如图是甲、乙、丙三种固体物质的溶解度曲线。

-
(1) P点表示的含义为。
-
(2) t1℃时,将120g甲物质的饱和溶液升温到t2℃,再加g甲物质,溶液达到饱和。
-
(3) 将t1℃时甲、乙、丙的饱和溶液升高到t2℃,所得溶液中溶质的质量分数由大到小的顺序为。
如图象反映的对应变化关系错误的是( )
A | B | C | D |
|
|
|
|
一定量的碳在密闭容器中燃烧 | 将水通直流电一段时间 | 向盐酸中不断滴加水 | t℃时向KNO3不饱和溶液中加入KNO3固体 |
A . A
B . B
C . C
D . D
最近更新







