中和反应及其应用 知识点题库
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
-
(1) 【学生板演】该反应的化学方程式 .
-
(2) 【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下,请你补上猜想四.
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是 ,
理由是 .
-
(3)
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 .
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaCl2溶液,进行如下三个方案的探究.
实验方案
测溶液的pH
滴加Na2CO3溶液
滴加BaCl2溶液
实验操作



实验现象
试纸变色,对比比色卡,pH<7
产生白色沉淀
实验结论
溶液中有H2SO4
溶液中有H2SO4
溶液中有H2SO4
-
(4) 【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了如下两处错误:
①实验操作中的错误是 ;
②实验方案中也有一个是错误的,错误的原因是 .
如图中A、B、C、D、E是初中化学常见的五种不同类别的物质,E是导致温室效应的一种气体,图中“﹣”表示 相连物质能发生化学反应,“→”表示两种物质间的转化关系(部分反应物及反应条件省略).

-
(1) 写出物质E的一种用途;
-
(2) 物质C与E反应的化学方程式是;
-
(3) 写出图中一个属于中和反应的化学方程式;
-
(4) 物质B中含有的阳离子为,A与B反应类型为
-
(1) 碘酒中的溶剂是;
-
(2) 实验室制氧气常用的催化剂是;
-
(3) 常用于治疗胃酸过多的药物是;
-
(4) 炉具清洁剂中含有的物质是;
-
(5) 测定空气中氧气含量所用的固体单质是;
-
(6) 用于配制农药波尔多液的是.

-
(1) 参观污水的第一道处理工序时,现场弥漫着难闻的气味,同学们不禁掩住口鼻。从微粒的角度说明能闻到气味的原因是。
-
(2) 污水的第一道处理工序是经过格栅,格栅是带有规则分布的方形网格,其作用是。
-
(3) 二次沉淀池的主要作用是分离出活性污泥。活性污泥的作用是利用微生物将污水中的一些有害物质在氧气的作用下经过生物降解转化为沼气。沼气(主要成分为甲烷)可作为能源使用。沼气燃烧的化学反应方程式为。
-
(4) 某工厂在排放含硫酸的酸性废水时用氢氧化钠进行处理,其反应的化学方程式为。

-
(1) M是 ,该反应的化学方程式。
-
(2) 反应过程中,老师取a、b、c三处反应后的溶液,打乱顺序后,请同学们不测定溶液的pH值,用其它方法对三种溶液进行探究。
小明和小红分别取其中一种溶液进行实验:
小明向所取溶液中加入溶液,观察到有蓝色沉淀生成。
结论:是a处溶液。
小红向少量另一种溶液中滴加酚酞溶液,观察到。
结论:是b处或c处溶液。
为进一步确定该溶液成分,小红又设计并完成如下实验:
实验步骤
实验现象
结论
为c处溶液,并推知溶液中的离子有(填写离子符号)
剩余一种为b处溶液。通过实验,同学们知道了酸碱反应过程中pH的变化和用不同方法确定溶液成分。

-
(1) 请根据图1、图2、图3任写一个反应的化学方程式。该反应属于反应(填基本反应类型);
-
(2) 任选一个反应从微观角度分析该反应的实质。
-
(3) 请你认真分析图1、图2、图3,从微观角度说明该反应类型发生反应的实质。



回答下列问题:
-
(1) 实验①观察到氢氧化钠表面变。
-
(2) 实验②观察到紫色石蕊溶液变成色,实验③观察到无色酚酞 溶液变成色。由此得出:碱溶液能使指示剂变色。
-
(3) 实验④:
I.当滴加稀盐酸至溶液呈中性时,溶液显色;继续滴加稀盐酸并用玻璃棒不断搅拌,此时溶液中的溶质除酚酞外还有、(填 化学式)
Ⅱ.如图是氢氧化钠与盐酸反应的微观模拟示意图:

从微观的角度分析,甲、乙两处应填入的离子符号分别为OH-和。
-
(4) 实验⑤观察到的现象是,说明碱溶液能与某些盐反应。该反应的化学方程式为。
-
(5) 实验④⑤对应的化学反应,属于中和反应的是(填数字序号)。
-
(6) 实验⑥⑦为用软矿泉水瓶所做的对比实验,装的软矿泉水瓶变瘪更明显,原因是(用化学方程式表示)。

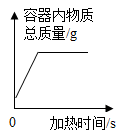 B . 在试管中加热一定量的高锰酸钾
B . 在试管中加热一定量的高锰酸钾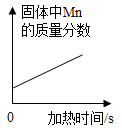 C . 向一定量的KOH溶液中滴加过量的稀硫酸
C . 向一定量的KOH溶液中滴加过量的稀硫酸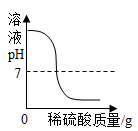 D . 向等质量的Mg、Al、Fe粉末中加入过量的10%稀盐酸
D . 向等质量的Mg、Al、Fe粉末中加入过量的10%稀盐酸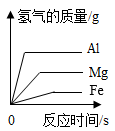
-
(1) 海水晒盐的基本原理为(填“蒸发结晶”“降温结晶”之一)。
-
(2) 海水淡化可采用膜分离技术,如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能透过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是____(填选项序号)。
 A . 溶质质量减少 B . 溶剂质量减少 C . 溶液质量减少 D . 溶质质量分数减小
A . 溶质质量减少 B . 溶剂质量减少 C . 溶液质量减少 D . 溶质质量分数减小 -
(3) 海水制镁的工艺流程如图,其中发生的中和反应的化学方程式为。

-
(4) 海水制碱:化学科学家侯德榜创立的侯氏制碱法,就是以食盐溶液、二氧化碳、氨气为原料制得纯碱的工艺。其生产过程中有下列反应:
①
 ;
;②2NaHCO3
 Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。碳酸氢钠和氯化铵的溶解度曲线如图所示。请回答下列问题:

①30℃时,NH4Cl的溶解度NaHCO3的溶解度(填“大于“小于”“等于”之一)。
②30℃时,将10 gNaHCO3加入50g水中,所得溶液的溶质质量分数为(计算结果精确到0.1%)。
③氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,从溶解度角度分析,首先结晶析出(填“碳酸氢钠”“氯化铵”之一)。



