纯碱的制取 知识点
纯碱的制取 知识点题库
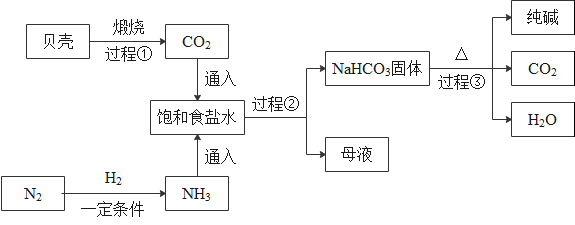
如图是工业上采用氨碱法生产纯碱的流程图:

上述过程的化学原理为:
NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
请回答下列问题:
(1)氨溶于水后会与水反应生成一水合氨(NH3•H2O),我们从酸碱反应的角度知道:在用氨碱法生产纯碱过程中,先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通过二氧化碳,其原因是 .
(2)氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,首先结晶析出的物质是碳酸氨钠,其原因是 .
(3)1926年,我国化学家侯德榜创立了更先进的联合制碱法,即向滤出碳酸钠晶体后的氯化铵溶液中加入食盐,使其中的氯化铵单独结晶析出,用作化肥中肥.同学们看见几株小树叶片变黄,从施肥角度分析,这些小树能否施用该化肥(填“能”或“不能”).
我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),促进了世界制碱技术的发展.下列有关说法正确的是( )
我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),促进了世界制碱技术的发展.下列有关说法正确的是( )

①NH3+H2O+CO2═NH4HCO3②NaCl(饱和)+NH4HCO3═NH4Cl+NaHCO3↓③2NaHCO3 Na2CO3+H2O+CO2↑下列说法不正确的是( )
Na2CO3+H2O+CO2↑下列说法不正确的是( )
①NH2+CO2+X=NH4HCO3
②NH4HCO3+NaCl=NH4Cl+NaHCO3↓
③2NaHCO3  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
请回答下列问题:
-
(1) 反应①中X的化学式为.
-
(2) 除去混在Na2CO3粉末中少量的NaHCO3的方法是.
-
(3) 工业纯碱中含有氯化钠,取55g工业纯碱,向其中加入269.5g稀盐酸,恰好完全反应,生成22g二氧化碳,求:
①工业纯碱中碳酸钠的质量分数.(计算结果保留到0.1%)
②反应后溶液中溶质的质量分数.
-
(1) 海水淡化是解决淡水资源不足的重要方法,下列方法中,可以使海水淡化的是 (填字母序号);A . 滤纸过滤 B . 吸附 C . 沉降 D . 蒸馏
-
(2) 从海水中提炼出来的重水(D2O)可作原子能反应堆中的减速剂和传热介质,重水中重氢原子(D)的相对原子质量是2,则重水中氧元素的质量分数为;
-
(3) 利用海水制取纯碱和金属镁的流程如图所示,试回答问题:

①1925年我国化学家创立了联合制碱法,促进了世界制碱技术的发展,其第Ⅲ步反应的化学方程式为;
②步骤Ⅴ中所加试剂是.
-
(1) 氨碱法生产所得产品为纯碱,向纯碱水溶液中滴入无色酚酞试液显色。
-
(2) 从步骤①提取粗盐常用(填“蒸发结晶”或“降温结晶”)方法。
-
(3) 从酸碱反应的角度分析,步骤④中通入氨气的作用是。
-
(4) 步骤⑤所得的碳酸氢钠在生产和生活中有许多重要用途,请写出它的一种用途。
-
(5) 步骤⑥中发生反应的化学方程式为,该反应类型属于反应。
-
(6) 工业产品中往往含有一些杂质,用“氨碱法”制得的纯碱含有少量氯化钠。为了测定该产品中碳酸钠的纯度,进行以下实验:取16.5g纯碱样品放入烧杯中,将烧杯放在电子天平上,再把150g稀盐酸(足量)加入样品中,观察读数变化如下表所示:
时间/s
0
5
10
15
读数/g
215.2
211.4
208.6
208.6
请你据此分析计算:
①实验中产生二氧化碳的质量为;
②该产品中碳酸钠的质量分数 (写出计算过程,结果精确到0.1%)

-
(1) 操作Ⅲ的名称是。
-
(2) 氨气极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合盐水(称为 氨盐水)。氨盐水比食盐水更容易吸收二氧化碳,其原因是;
-
(3) 写出制取碳酸氢钠的化学方程式。

(查阅资料)粗盐中含有CaCl2、MgCl2等可溶性杂质。
-
(1) 粗盐水精制的过程中先加过量的NaOH溶液,发生反应的化学方程式是;再加入过量的碳酸钠溶液,其目的是除尽(填名称)。
-
(2) 煅烧后的产物X 是一种盐,写出其化学式:。
-
(3) Y是滤液中的主要成分,可作氮肥,但不能与碱性物质混合施用,原因是。
-
(4) 该流程中可用于循环使用的物质有氨气和(填名称)。

有关说法正确的是()
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
[小资料]
I .贝壳的主要成分是CaCO3;
II.通常情况下,1体积水中大约能溶解700体积氨气,1体积水中大约能溶解1体积二氧化碳;
Ⅲ.饱和食盐水中发生的主要反应为  ,
, 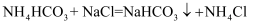 (NaHCO3由于饱和后析出,变成沉淀)。
(NaHCO3由于饱和后析出,变成沉淀)。
-
(1) 过程②中主要操作的名称是。
-
(2) 为了提高产率,往饱和食盐水中通入气体时,你认为应该先通入NH3后通入CO2 , 你的理由是。
-
(3) 上述流程中可以循环利用的物质是(填化学式)。
Ⅰ.索尔维法的原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 
Ⅱ.氨气(NH3)是一种有刺激性气味、极易溶于水的碱性气体。
Ⅲ.Na2CO3与HCl的反应分步进行,首先发生反应: Na2CO3+HCl=NaHCO3+NaCl
-
(1) 我国化学家侯德榜在吕布兰法和素尔维法的基础上创立了先进的侯氏制碱法,基本消除废弃物的排放,同时生产NaHCO3和NH4Cl。
实验室检验氯化铵中含有铵根离子的方法是:取样,加入氢氧化钠溶液,在酒精灯上微热,再将试纸放在试管口,变蓝,则证明含有铵根。
-
(2) (实验目的)利用如图所示装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。

(实验设计)
步骤1:关闭K1打开K2使氨气进入装置C,调节气流速率,待装置C中气流平稳后,打开K1通入CO2。
步骤2:待装置C的锥形瓶内出现较多固体时,关闭K2停止通NH3 , 一段时间后,关闭K1停止通CO2。
步骤3:将锥形瓶内反应后的混合物过滤、洗涤、低温干燥,即得碳酸氢钠固体。
步骤4:将所得碳酸氢钠固体加热制取碳酸钠。
(表达交流)
①装置B中饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为。
②装置C锥形瓶上连接的长颈漏斗的作用是(填序号)。
A 用于添加饱和食盐水
B 平衡气压
C 冷凝回流
③步骤2中关闭K2停止通NH3后,还要继续通一段时间CO2 , 其目的是。
④步骤3中“低温干燥”的原因是。
-
(3) (反思评价)
有同学认为应该在C的长颈漏斗内放置一团蘸有酸液的棉花,理由是。
-
(4) (延伸拓展)
以前实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30~35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体.
四种盐在不同温度下的溶解度表:(留100g水)
温度溶解度
0℃
10℃
20℃
30℃
40℃
50℃
60℃
100℃
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
39.8
NH4HCO3
11.9
15.8
21.0
27.0
-
-
-
-
NaHCO3
6.9
8.1
9.6
11.1
12.7
14.5
16.4
-
NH4Cl
29.4
33.3
37.2
41.4
45.8
50.4
55.3
77.3
①静置后只析出NaHCO3晶体的原因。
②过滤所得母液中含有NaHCO3、NaCl、NH4Cl、NH4HCO3 , 加入适当试剂并作进一步处理,使(填化学式)循环使用,回收得到NH4Cl晶体。
-
(5) 分别取碳酸氢钠4.2g和碳酸钠5.3g放入相同大小的锥形瓶中,分别在密闭条件下加入相同质量、相同浓度的盐酸(足量)。在相同的条件下,测量出生成气体的体积,得到时间-体积关系曲线图应为。
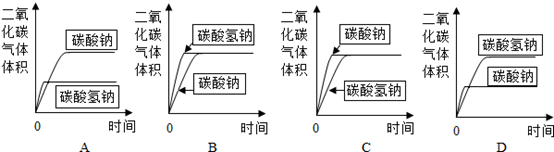
①NH3+CO2+H2O═NH4HCO3
②NH4HCO3+NaCl═NH4Cl+NaHCO3↓
③2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
下列说法错误的是( )
-
(1) 化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色 溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如下表(微溶物视为可溶物):
实验
A+B
A+C
A+D
B+C
现象
产生气体
产生沉淀
产生沉淀
产生沉淀
①写出溶液 B、C 中溶质的化学式: B,C。
②写出溶液 A 与 D 反应的化学方程式。
-
(2) 我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:
NaCl+H2O+NH3+CO2=NaHCO3↓+X; 2NaHCO3=Na2CO3+H2O+CO2↑等;
回答下列问题:
①X 的化学式为。
②将碳酸钠和碳酸氢钠的混合物10g 充分加热至质量不再改变,冷却,称量剩余固体 质量为 6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为(写最简比)。
已知:① ;②
;②
-
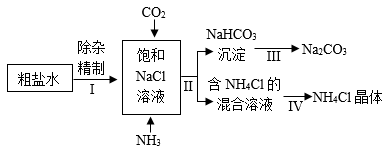
(1) 粗盐水中主要含有Na2SO4、MgCl2、CaCl2三种可溶性杂质,工业上常用加入稍过量的溶液、NaOH溶液、Na2CO3溶液及适量的盐酸等除杂、精制。
-
(2) Ⅱ中发生反应的化学方程式为。
-
(3) 氯化铵属于化肥中的,不采用蒸发结晶的方法得到氯化铵晶体的原因是。
-
(4) 该流程中可循环利用的物质是水、。



