蒸发和结晶、重结晶 知识点题库
进行蒸发操作时,下列操作正确的是( )
A . 使蒸发皿盛满滤液,用小火加热
B . 等到蒸发皿中出现较多量固体时停止加热
C . 待溶液蒸干后,再停止加热
D . 将蒸发皿放在石棉网上,用酒精灯加热
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( )
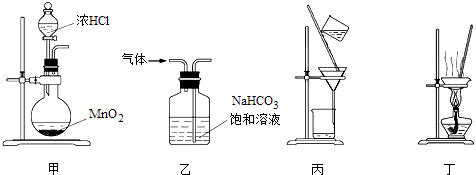
A . 用装置甲制取氯气
B . 用装置乙除去氯气中混有的少量氯化氢
C . 用装置丙分离二氧化锰和氯化锰溶液
D . 用装置丁蒸干氯化锰溶液制MnCl2•4H2O
电解质在溶液中的行为是化学研究的重要内容,下列有关溶液的叙述不正确的是( )
A . 加热蒸干NaCl、MgCl2溶液时可以得到晶体NaCl、MgCl2
B . 相同条件下,等物质的量浓度的溶液导电能力:HCl>NH3•H2O
C . 溶液中离子结合质子(氢离子)的能力:C2O42﹣>HC2O4﹣>SO42﹣
D . 海洋封存CO2会导致局部海洋水体酸性增强,会破坏海洋生态环境
下面关于实验操作、现象或原理的叙述中正确的是( )
A . 在“阿司匹林的合成”实验中,把从盐酸中析出的晶体进行抽滤,用乙醇洗涤晶体1~2次,然后抽滤,将晶体转移到表面皿上,干燥后称其质量,计算产率
B . 晶体颗粒的大小与结晶条件有关,溶质的溶解度越小,或溶液的浓度越高,或溶剂的蒸发速度越快,析出的晶粒就越细小
C . 牙膏中的保湿剂(甘油),可用氢氧化铜浊液根据产生的绛蓝色沉淀来检验
D . 在试管中将一定量的浓硝酸、浓硫酸和苯混合,用酒精灯直接加热几分钟,即可制得硝基苯
下列实验方案设计正确的是( )
A . 分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
B . 将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体
C . 失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液,可以用碳酸铵溶液鉴别
D . 检验从火星上带回来的红色物体是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
下列实验操作中正确的是( )
A . 蒸发操作时,应使混合物中的水分完全蒸干后才能停止加热
B . 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处
C . 分液操作时,分液漏斗中下层液体从下口放出后,再将上层液体从下口放出到另一个烧杯
D . 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
下列装置不是用于物质分离提纯的是( )
A . 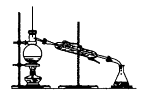 B .
B . 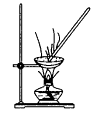 C .
C . 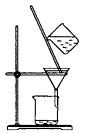 D .
D . 
 B .
B .  C .
C .  D .
D . 
下列实验操作中错误的是( )
A . 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B . 蒸馏时,应使温度计水银球与蒸馏烧瓶支管口齐平
C . 可用酒精萃取碘水中的碘
D . 用重结晶方法进行提纯的有机物在一定溶剂中的溶解度应随温度变化大
钼(Mo)是一种重要的过渡金属元素,工业上由钼精矿(主要成分是MoS2)制备单质钼和钼酸钠晶体(Na2MoO4·2H2O)的流程如下:
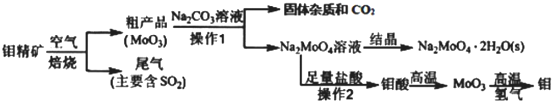
-
(1) Na2MoO4·2H2O中Mo元素的化合价为;钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为。
-
(2) 流程中由Na2MoO4溶液获得晶体的操作是、过滤、洗涤、干燥。加入Na2CO3溶浸时发生的主要反应的离子方程式为。
-
(3) 操作1中,所得Na2MoO4溶液中含SO42+杂质,其中c(MoO42+)0.80mol/L,c(SO42-)=0.04mol/L在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当 BaMoO4开始沉淀时,SO42-的去除率是。[Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8 , 溶液体积变化可忽略]
-
(4) 工业上钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,该法的优点是。
-
(5) 高纯Mo可用于制造电池级MoS2 , Li-MoS2电池是一种性能优异的二次电池,其电池反应为:xLi+nMoS2
 Lix(MoS2)n , 该电池放电时正极反应为;充电时Li+移动方向为(填“由阳极移向阴极”或“由阴极移向阳极”)。
Lix(MoS2)n , 该电池放电时正极反应为;充电时Li+移动方向为(填“由阳极移向阴极”或“由阴极移向阳极”)。
下列混合物能用溶解、过滤、蒸发三步操作分离的是( )
A . 水和酒精的混合物
B . 食盐和蔗糖的混合物
C . 氯化钾和氯化银的混合物
D . 硫酸钡和水的混合物
下列实验中均需要的仪器是( )
①配制一定物质的量浓度的溶液 ②pH试纸的使用 ③过滤 ④蒸发
A . 试管
B . 胶头滴管
C . 玻璃棒
D . 漏斗
工业上以钛铁矿(主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2等杂质)为原料,制备金属钛和铁红的工艺流程如下:
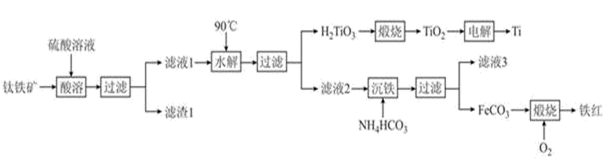
已知:酸溶时,FeTiO3转化为Fe2+和TiO2+
-
(1) FeTiO3中Ti元素的化合价为价,铁红的用途为(任写一种)。
-
(2) “水解”中,发生反应的离子方程式为。
-
(3) “沉铁”中,生成的酸性气态产物的电子式为;该过程控制反应温度低于35℃,原因为。
-
(4) FeCO3转化为铁红时,发生的化学方程式为。
-
(5) 制得的FeCO3可加入足量的稀硫酸,则从溶液中获得绿矾的操作是。
-
(6) 电解生产钛时用TiO2 和石墨做电极,电解质为熔融的CaO,则阴极的反应式为。
下列说法错误的是( )
A . 当溶液发生过饱和现象时,振荡容器可促使晶体析出
B . 硝酸钾溶液含有少量氯化钠,可用蒸发浓缩、冷却结晶来提纯硝酸钾
C . 抽滤洗涤沉淀时,关小水龙头,使洗涤剂缓慢通过沉淀物
D . 纸层析实验中,滤纸作为固定相,展开剂作为流动相
由于生产、生活和科学研究的目的不同,因此对物质的分离和提纯的质量标准有不同的要求。下列分离或制备方法能达到相应实验目的的是( )
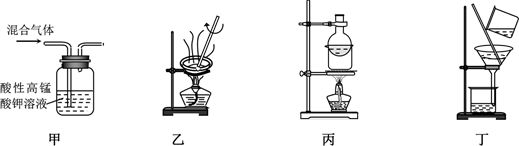
A . 用装置甲除去乙烯中的少量SO2
B . 用装置乙除去碳酸氢钠中的少量碳酸钠
C . 用装置丙除去固体碘中的少量NH4Cl
D . 用装置丁分离氯酸钾溶液和二氧化锰的混合物
-
(1) Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO
 ,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂(盐酸、Na2CO3、NaOH、BaCl2)除去食盐水中Ca2+、Mg2+、SO
,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂(盐酸、Na2CO3、NaOH、BaCl2)除去食盐水中Ca2+、Mg2+、SO  。各步操作流程如图:
。各步操作流程如图: 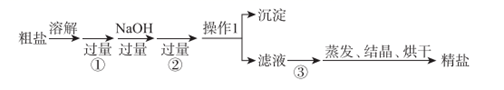
试回答:
操作1名称为,需要使用的玻璃仪器是;蒸发时时停止加热。
-
(2) 加入的试剂①、②分别为、。加入试剂②的目的是(用离子方程式表示)。
-
(3) 试剂③能否在操作1之前加入:(填“能”或“不能”),判断试剂③已经足量的简便方法为。
-
(4) 纯度测定:称取0.0480g精盐配制成100mL溶液,每次移取25mL,加入几滴K2CrO4指示剂,用0.01 mol·L-1的AgNO3标准液滴定至溶液呈砖红色即为终点,三次滴定平均消耗20.0mL的AgNO3溶液,则该精盐样品中NaCl的质量分数是%。
-
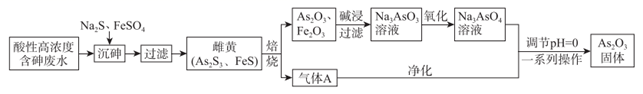
(5) Ⅱ.目前中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分为As2O3)可用于治疗急性白血病。工业上利用酸性高浓度含砷废水[砷主要以亚砷酸(H3AsO3)形式存在]提取As2O3的工艺流程如图:
已知:As2S3与过量的S2-可发生反应:As2S3(s)+3S2-(aq)
 2AsS
2AsS 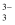
回答下列问题:
As元素在元素周期表中位于N元素的下方,下列说法错误的是(填序号)。
①As元素非金属性比N强
②N的原子半径比As的原子半径小
③HNO3的酸性比H3AsO4强
-
(6) H3AsO3是一种两性偏酸性的化合物,其中As元素的化合价为。
-
(7) “沉砷”中FeSO4的作用是。
-
(8) “焙烧”过程产生的气体A的化学式为。
实验室合成三苯基膦(C6H5)3P,并从反应后的废渣中获取MgCl2∙6H2O。
-
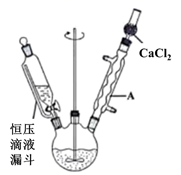
(1) I.合成三苯基膦(C6H5)3P
反应装置如图所示(夹持仪器已略去)。先向三颈烧瓶中加入氯苯和溶剂(四氢呋喃),然后加入镁屑,反应制得C6H5MgCl;再从滴液漏斗中缓慢加入PCl3 , 控制反应温度在40~50℃。
相关物质的部分性质如下表:
物质
熔点/℃
沸点/℃
部分性质
三苯基膦
78.5
377
与水剧烈反应
四氢呋喃
−108.5
65.4
对环境有污染
三氯化磷
−111.8
76
与水剧烈反应
装置中仪器A的名称为。与普通分液漏斗比较,使用恒压滴液漏斗的优点是:使漏斗内液体顺利滴下、。
-
(2) 实验宜使用的加热方法为。
-
(3) II.获取MgCl2∙6H2O
提取(C6H5)3P后的废渣中含MgCl2、四氢呋喃、(C6H5)3P等。以该废渣为原料,获取MgCl2∙6H2O的主要实验流程如下:

其他条件相同时,水浸相同时间,水浸温度与MgCl2∙6H2O获取率关系如下图所示,分析曲线在不同温度段趋势变化的原因:A→B段;D→E段。
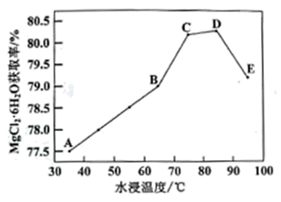
-
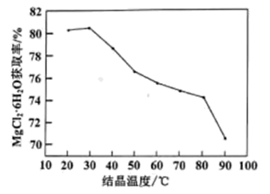
(4) 过滤后得到的滤液中主要含MgCl2、四氢呋喃。结晶温度与MgCl2∙6H2O回收率的关系如下图所示。补充完整获取MgCl2∙6H2O的实验方案:取酸浸后滤液,。
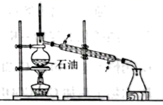
用下列实验装置能达到相关实验目的的是( )
|
A |
B |
C |
D |
|
|
实验装置 |
|
|
|
|
|
实验目的 |
由 |
制备乙酸乙酯 |
除去 |
石油分馏制备汽油 |
A . A
B . B
C . C
D . D
从砷化镓废料(主要成分为GaAs、Fe2O3、SiO2和CaCO3)中回收镓和砷的工艺流程如图所示。
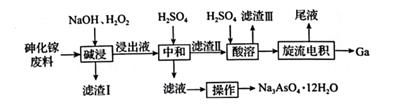
下列说法错误的是( )
A . “碱浸”时,温度保持在70℃的目的是提高“碱浸"速率,同时防止H2O2过度分解
B . “碱浸”时,GaAs被H2O2氧化,每反应1 mol GaAs,转移电子的数目为5NA
C . “旋流电积”所得“尾液”溶质主要是H2SO4 , 可进行循环利用,提高经济效益
D . 该工艺得到的Na3AsO4·12H2O纯度较低,可以通过重结晶的方法进行提纯
工业上以金焙砂酸浸液(主要成分为Fe2(SO4)3和FeSO4 , 忽略其它杂质)与硫铁矿(主要成分为FeS2 , 忽略其它杂质)为原料制备Fe3O4的流程如下:
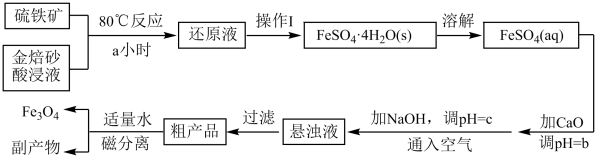
回答下列问题:
-
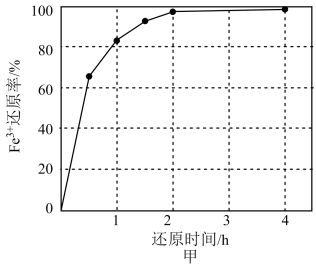
(1) 硫铁矿和金焙砂酸浸液反应的离子方程式为 。还原时间与 Fe3+还原率的关系如图甲所示,则最佳还原时间为a= 小时,理由是。
-
(2) 操作I为、、过滤、洗涤、干燥。
-
(3) “溶解” 并恢复室温后,若溶液中c(Fe2+)=2 mol·L-1 , 为防止Fe2+沉淀,加CaO调pH最高为b= (已知Ksp[Fe(OH)2] = 8 ×10-16 , lg5 取0.7)。
-
(4) 加NaOH调pH时,pH与悬浊液中
 的关系如图乙所示,则调pH为c=(填具体值),向调pH后的溶液中通入空气的目的是。
的关系如图乙所示,则调pH为c=(填具体值),向调pH后的溶液中通入空气的目的是。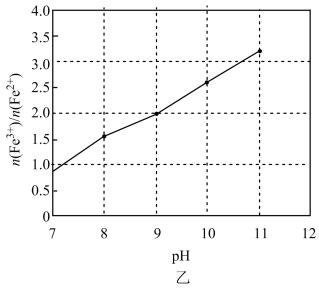
-
(5) 磁分离后所得副产物是一种盐,可用作建筑材料,其化学式为。
以含钴废渣制备 需经历酸浸、还原、沉钴、过滤、灼烧等操作。下列实验装置能达到实验目的的是( )
需经历酸浸、还原、沉钴、过滤、灼烧等操作。下列实验装置能达到实验目的的是( )
 需经历酸浸、还原、沉钴、过滤、灼烧等操作。下列实验装置能达到实验目的的是( )
需经历酸浸、还原、沉钴、过滤、灼烧等操作。下列实验装置能达到实验目的的是( )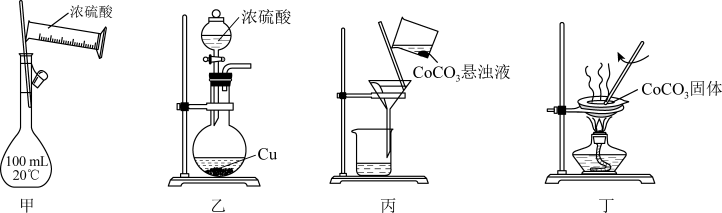
A . 用甲配制“酸浸”所需的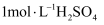 溶液
B . 用乙制备“还原”所需的
溶液
B . 用乙制备“还原”所需的 气体
C . 用丙过滤“沉钴”所得悬浊液
D . 用丁灼烧
气体
C . 用丙过滤“沉钴”所得悬浊液
D . 用丁灼烧 固体制
固体制
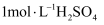 溶液
B . 用乙制备“还原”所需的
溶液
B . 用乙制备“还原”所需的 气体
C . 用丙过滤“沉钴”所得悬浊液
D . 用丁灼烧
气体
C . 用丙过滤“沉钴”所得悬浊液
D . 用丁灼烧 固体制
固体制
最近更新
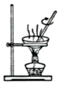
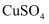 溶液制取胆矾
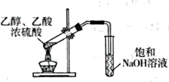
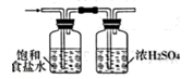
溶液制取胆矾 气体中混有的HCl杂质
气体中混有的HCl杂质


