蒸发和结晶、重结晶 知识点题库
蒸发操作中必须用到蒸发皿,下面对蒸发皿的操作中正确的是( )
A . 将蒸发皿放置在铁架台的铁圈上直接用酒精灯火焰加热
B . 将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热
C . 将蒸发皿放置在三脚架上直接用酒精灯火焰加热
D . 在三脚架上放置泥三角,将蒸发皿放置在泥三角上加热
在蒸发皿中蒸发液体,下列操作不正确的是( )
A . 直接用酒精灯的外焰加热蒸发皿
B . 加热过程中不断用玻璃棒搅拌
C . 加热到液体全部消失
D . 蒸发皿中出现多量晶体、少量液体时,停止加热,利用蒸发皿的余热烘干
下列操作中正确的是( )
A . 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B . 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的底部.
C . 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D . 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
如图1可实现由亚硫酸钠和硫粉反应制硫代硫酸钠(Na2S2O3).已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2.下列说法错误的是( )
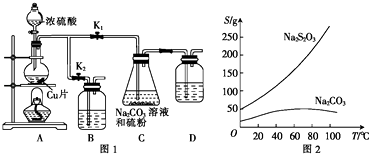
A . 盛装浓硫酸的仪器的名称为分液漏斗
B . B、D中都可以盛放氢氧化钠溶液,防止污染
C . 该装置设计不够严密,可能会出现倒吸
D . 析出硫代硫酸钠晶体的方法是蒸发结晶
净水剂能够改善水质,给人们的生活、健康带来很大的益处。
-
(1) 明矾[KAl(SO4)2·12H2O]是常见的净水剂。其在水中的电离方程式为;明矾可净水是因为在天然水中生成胶状Al(OH)3 , Al(OH)3具有的作用。
-
(2) 碱式氯化铝(简称BAC)是高效净水剂的主要成分。实验室模拟利用铝土矿(主要含Al2O3 , 还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝[Al2(OH)nCl6-n]的过程如下:

①盐酸溶解铝土矿过程中,发生反应的离子方程式为、;溶解过程中需不断搅拌,目的是。
②加适量铝粉的主要作用是。
③蒸发浓缩所需玻璃仪器为。
下列实验操作能达到实验目的的是( )
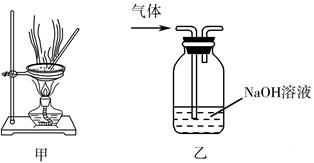
A . 用经水湿润的pH试纸测量溶液的pH
B . 将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 mol·L−1NaOH溶液
C . 用装置甲蒸干AlCl3溶液制无水AlCl3固体
D . 用装置乙除去实验室所制乙烯中的少量SO2
粗盐中含有不溶性的泥沙,可溶性的CaCl2、MgCl2及Na2SO4等杂质。
-
(1) 经过溶解、、蒸发等操作可将粗盐初步提纯;
-
(2) 在蒸发过程中需要用到的仪器有铁架台、酒精灯、玻璃棒和;
-
(3) 检验粗盐中是否含有SO42-所用的试剂是和。
硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
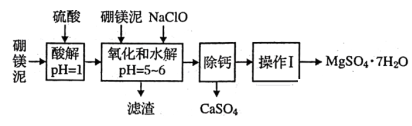
-
(1) 实验中需用1mol/L的硫酸480mL,若用18.4mol/L的浓硫酸来配置,量取浓硫酸时需使用的量筒规格为()。
A 10mL B 20mL C 50mL D 100mL
-
(2) 加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-还有一种离子也会被NaClO氧化,该反应的离子方程式为;滤渣中除含有氢氧化铁、氢氧化铝外还有。
-
(3) 在“除钙”前需检验滤液中Fe3+是否被除尽,简述检验方法。
-
(4) 已知硫酸镁、硫酸钙的溶解度如下表
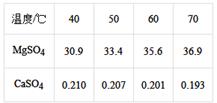
“除钙”是将;硫酸镁和硫酸钙混合溶液中的硫酸钙除去根据上表数据,采取的操作是、趁热过滤、、,便得到比较纯净的硫酸镁。
-
(5) 实验中提供的硼镁泥共100g,得到的MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为。
下列实验操作正确的是( )
A . 用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH试纸
B . 蒸馏石油时为了更好地控制温度,应将温度计的水银球伸入液面以下
C . 蒸发结晶时不能将溶液全部蒸干,应该在有大量晶体析出时停止加热
D . 稀释浓硫酸时,可向盛有浓硫酸的烧杯中直接加蒸馏水
Ⅰ、选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液法 B.加热分解 C.结晶法 D.分液法 E.渗析法 F.蒸馏法 G.过滤法
-
(1) 分离水和煤油的混合物。
-
(2) 分离水和酒精。
-
(3) 分离溴水中的溴和水。
-
(4) 上述仪器中,在配制稀H2SO4时不需要使用的有(填代号),还缺少的仪器是;
-
(5) 经计算,需浓H2SO4的体积为;如果实验室有15mL、20mL、50mL的量筒应选用mL的量筒最好,量取时俯视量筒读数将使浓度(“偏高”、“偏低”、“无影响”);
-
(6) 将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是,若未冷却至室温便将溶液转移至容量瓶会使浓度偏。
关于下列实验装置的说法正确的是( )
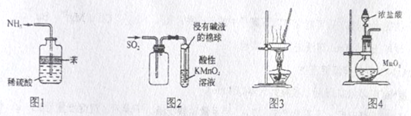
A . 用图1吸收多余氨气且防止倒吸
B . 用图2收集SO2并验证其还原性
C . 图3蒸干NH4Cl饱和溶液制备NH4Cl晶体
D . 用图4实验室制取氯气
硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
-
(1) I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
A仪器的名称为。
-
(2) 某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因。
-
(3) II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作
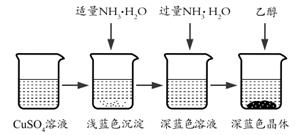
已知浅蓝色沉淀的成分为Cu2(OH)2SO4 , 试写出生成此沉淀的离子反应方程式。
-
(4) 析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是。
-
(5) III.氨含量的测定
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mLClmol/L的盐酸标准溶液完全吸收。取下接收瓶,用C2mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。
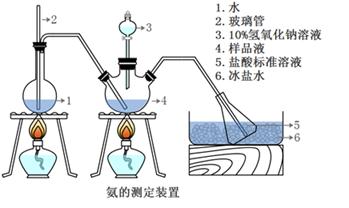
玻璃管2的作用,样品中氨的质量分数的表达式。
-
(6) 下列实验操作可能使氨含量测定结果偏低的原因是____________________。A . 滴定时未用NaOH标准溶液润洗滴定管 B . 读数时,滴定前平视,滴定后俯视 C . 滴定过程中选用酚酞作指示剂 D . 取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁
利用乙醚、95%乙醇浸泡杜仲干叶,得到提取液,进步获得绿原酸粗产品的种工艺流程如下,下列说法不正确的是( )
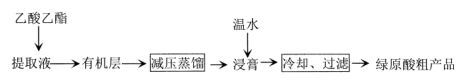
A . 常温下,绿原酸易溶于水
B . 浸膏的主要成分是绿原酸
C . 减压蒸馏的目的是降低蒸馏温度,以免绿原酸变质
D . 绿原酸粗产品可以通过重结晶进一步提纯
下列实验操作能达到实验目的的是 ( )
A . 用热的碳酸钠溶液洗涤试管内壁的油污
B . 需将 pH 试纸润湿来测定 Na2CO3 溶液 pH
C . 蒸发 AlCl3 溶液获得无水 AlCl3
D . 用 CCl4 从溴水中萃取溴时,先从分液漏斗下端管口放出有机层,再放出水层
下列有关实验装置的叙述正确的是( )
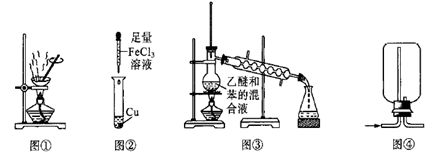
A . 用图①装置蒸发KCl溶液制备KCl晶体
B . 用图②装置比较Fe、Cu的金属性强弱
C . 用图③装置分离乙醚和苯
D . 用图④装置收集H2、CH4、NO等气体
结晶操作中需要用到的仪器是( )
A . 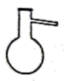 B .
B .  C .
C .  D .
D . 
 B .
B .  D .
D . 
下列实验设计能达到实验目的的是( )
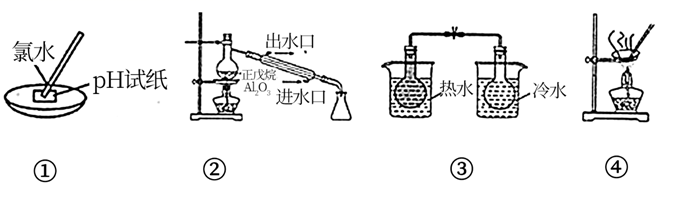
A . ①用于测量氯水的  B . ②可以探究正戊烷(
B . ②可以探究正戊烷( 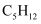 )催化裂化
C . ③可用于探究温度对
)催化裂化
C . ③可用于探究温度对 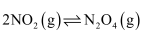 平衡移动的影响
D . ④用
平衡移动的影响
D . ④用  溶液制备
溶液制备  晶体
晶体
 B . ②可以探究正戊烷(
B . ②可以探究正戊烷( 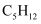 )催化裂化
C . ③可用于探究温度对
)催化裂化
C . ③可用于探究温度对 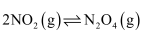 平衡移动的影响
D . ④用
平衡移动的影响
D . ④用  溶液制备
溶液制备  晶体
晶体
下列有关说法正确的是( )
A . CaCO3(s) =CaO(s)+CO2(g) 在室温下不能自发进行,说明该反应  H<0
B . 水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应
C . 0.1mol·L-1Na2CO3溶液在50℃时的碱性比25℃强,说明盐类水解反应是放热反应
D . 蒸发FeCl3溶液,所得固体在坩埚中充分加热,最后得到Fe2O3固体
H<0
B . 水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应
C . 0.1mol·L-1Na2CO3溶液在50℃时的碱性比25℃强,说明盐类水解反应是放热反应
D . 蒸发FeCl3溶液,所得固体在坩埚中充分加热,最后得到Fe2O3固体
 H<0
B . 水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应
C . 0.1mol·L-1Na2CO3溶液在50℃时的碱性比25℃强,说明盐类水解反应是放热反应
D . 蒸发FeCl3溶液,所得固体在坩埚中充分加热,最后得到Fe2O3固体
H<0
B . 水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应
C . 0.1mol·L-1Na2CO3溶液在50℃时的碱性比25℃强,说明盐类水解反应是放热反应
D . 蒸发FeCl3溶液,所得固体在坩埚中充分加热,最后得到Fe2O3固体
下列实验中,所选装置不合理的是( )
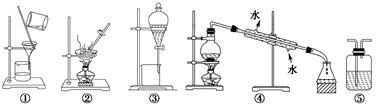
A . 粗盐提纯,选①和②
B . 分离食用油和水的混合液,选④
C . 用NaOH溶液吸收少量Cl2 , 选⑤
D . 用CCl4提取溴水中的溴,选③
碲被誉为现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁。工业上从某电镀污泥(含有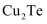 、
、 以及少量的Au)中提取粗碲,同时获得副产品重铬酸钾、金属铜和金的工艺流程如图所示。
以及少量的Au)中提取粗碲,同时获得副产品重铬酸钾、金属铜和金的工艺流程如图所示。
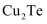 、
、 以及少量的Au)中提取粗碲,同时获得副产品重铬酸钾、金属铜和金的工艺流程如图所示。
以及少量的Au)中提取粗碲,同时获得副产品重铬酸钾、金属铜和金的工艺流程如图所示。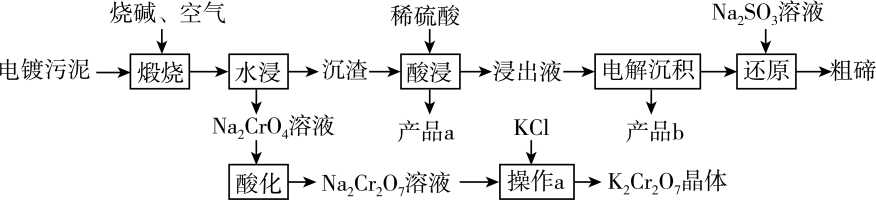
已知:①沉淀时 与pH的关系
与pH的关系
| pH | |
开始沉淀 |
| 3.68 |
沉淀完全 |
| 5 |
②溶解度
溶解度 |
| NaCl |
100℃ | 95.1g | 39.8g |
25℃ | 4.6g | 36g |
回答下列问题:
-
(1) “煅烧”时气体与固体原料逆流而行,目的是;“煅烧”时
 发生反应的化学方程式为。
发生反应的化学方程式为。
-
(2) 金在(填操作单元名称)过程中回收。已知浸出液中含有
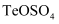 , 每得到128g碲,理论上消耗
, 每得到128g碲,理论上消耗 溶液的体积为L。
溶液的体积为L。
-
(3) 根据相关物质溶解度特点分析“操作a”的步骤:向
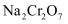 溶液中加入KCl固体,(填操作名称,下同),使NaCl结晶析出后,再得到
溶液中加入KCl固体,(填操作名称,下同),使NaCl结晶析出后,再得到 晶体。
晶体。
-
(4) 铬(VI)毒性很高,工业上常用铁和石墨作电极,处理含
 的酸性废水。通电后
的酸性废水。通电后 先转变为
先转变为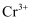 , 一段时间后变成
, 一段时间后变成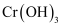 沉淀而被除去。其中铁电极的作用是电子导体和,当电解后溶液中
沉淀而被除去。其中铁电极的作用是电子导体和,当电解后溶液中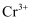 浓度为
浓度为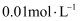 时,其开始沉降时废水的pH为。
时,其开始沉降时废水的pH为。
最近更新