蒸发和结晶、重结晶 知识点题库
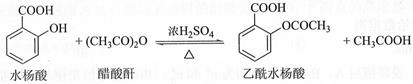
| 水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
| 熔点/℃ | 157~159 | -72~-74 | 135~138 |
| 相对密度/(g·cm﹣3) | 1.44 | 1.10 | 1.35 |
| 相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
-
(1) 该合成反应中应采用__________加热。(填标号)A . 热水浴 B . 酒精灯 C . 煤气灯 D . 电炉
-
(2) 下列玻璃仪器中,①中需使用的有(填标号),不需使用的(填名称)。
-
(3) ①中需使用冷水,目的是。
-
(4) ②中饱和碳酸氢钠的作用是,以便过滤除去难溶杂质。
-
(5) ④采用的纯化方法为。
-
(6) 本实验的产率是%。
-
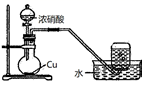
(1) 甲同学用Co2O3与盐酸反应制备CoCl2•4H2O,其实验装置如下:

①烧瓶中发生反应的离子方程式为。
②由烧瓶中的溶液制取干燥的CoCl2•4H2O,还需经过的操作有蒸发浓缩、、洗涤、干燥等。
-
(2) 乙同学利用甲同学制得的CoCl2•4H2O在醋酸氛围中制得无水(CH3COO)2Co,并利用下列装置检验(CH3COO)2Co在氮气气氛中的分解产物。已知PdCl2溶液能被CO还原为Pd。

①装置E、F是用于检验CO和CO2的,其中盛放PdCl2溶液的是装置(填“E”或“F”)。
②装置G的作用是;E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是。
③通氮气的作用是。
④实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是。
⑤若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6 , 且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为。
 B . 点燃酒精灯
B . 点燃酒精灯  C . 过滤
C . 过滤  D . 移开蒸发皿
D . 移开蒸发皿 
| | | | |
| A.用海水制取蒸馏水 | B.分离水和乙醇 | C.除去水中的泥沙 | D.从食盐水中获取氯化钠 |
①用剩的药品为避免浪费应放回原瓶
②蒸发氯化钠溶液时要用玻璃棒不断搅拌
③称取易潮解的药品必须放在玻璃器皿中称量
④用试纸检验气体性质时,手拿着试纸经水润湿后靠近气体观察试纸颜色变化
-
(1) 制法一:将80%醋酸用水稀释后,水浴加热至60~ 80℃,在搅拌下分批少量加入碳酸镁至CO2不再逸出为止,继续加热,趁热过滤。在滤液中补充适量醋酸,……,得到四水醋酸镁晶体,……,即得无水醋酸镁,碳酸镁需分批少量加入,理由是。
-
(2) 滤液中补充适量醋酸的目的是。
-
(3) 从下列提供的操作中选择必要的操作(可重复使用),将制法一中“……”处的步骤补充完整,正确的顺序是 ,。 (填编号)

-
(4) 制法二 :将六水硝酸镁与醋酸酐混合加热,发生反应:(具体步骤略去)
2Mg(NO3)2•6H2O+ 14(CH3CO )2O
 2Mg(CH3COO )2+ 4NO 2↑+ O2↑+24CH3COOH
2Mg(CH3COO )2+ 4NO 2↑+ O2↑+24CH3COOH用七水硫酸镁代替六水硝酸镁按相同操作进行制备实验,无法得到产品,原因是 。
-
(5) 以铬黑T(BET)为指示剂 ,用 EDTA测定Mg2+含量的原理用方程式可表示为:
EDTA (无色)+Mg-BET (紫红)= BET (蓝色)+ Mg-EDTA (无色)
为测定产品纯度,称取试样0.3000 g 于锥形瓶中,加入100ml 蒸馏水,待完全溶解后加入l 0mLpH=l 0的氨-氯化铁缓冲溶液,溶液变浑浊,再滴加3~ 4 滴铬黑 T 指示剂 (BET),用0.1000mol∙L-1 的 EDTA标准溶液滴定至终点,重复上述操作两次平均消耗 EDTA 标准溶液 20.50mL。
①滴定终点的现象为 。
②产品中镁元素的质量分数为(保留四位有效数字)。
-
(6) 下列关于该实验的操作或分析 ,正确的是__________(填编号)。A . 用倾析法将固液混合物转移至布氏漏斗中进行抽滤时,先转移溶液再转移沉淀 B . 称取一定质量的产品时,若电子天平未调整水平,则称得的产品偏多 C . 开始滴定前,滴定管尖悬挂的液滴需擦去,否则可能引起结果偏低 D . 根据(5)的测定方法可知,Mg(OH)2可溶于EDTA溶液
| | | | |
| A.除去苯中混有的水 | B.制备并收集少量 | C.从 | D.测定中和反应的反应热 |
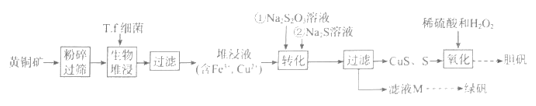
已知:①T.f细菌在1.0<pH<6.0范围内保持生物活性。
②几种离子形成氢氧化物沉淀的pH如表所示:
|
Fe3+ |
Fe2+ |
Cu2+ |
|
|
开始沉淀时的pH |
1.9 |
7.0 |
4.2 |
|
完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
回答下列问题:
-
(1) 从物质分类的角度看,本题中涉及的“矾”属于 (填序号)。
A.化合物 B.硫酸盐 C.混合物 D.复盐
为了提高生物堆浸速率,上述流程采用的措施是。
-
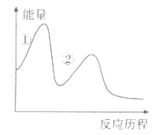
(2) 生物堆浸包括两个过程:
①CuFeS2+4H++O2=Cu2++Fe2++2S+2H2O;②(补充离子方程式)。
这两个过程中的能量变化如图所示,其中控制生物堆浸总速率的是 (填“①”或“②")。生物堆浸过程中应控制溶液pH的范围为。
-
(3) 检验滤液M中是否含硫酸铁的试剂为(填化学式)。在确定无Fe3+后,滤液M先加入少量稀硫酸,目的是。然后经过、洗涤、干燥制得绿矾。
-
(4) 测定绿矾(FeSO4·7H2O,式量为278)样品的纯度。取wg绿矾样品溶于稀硫酸中,配制成100 mL溶液。取25.00 mL配制溶液于锥形瓶中,将c mol·L-1标准KMnO4溶液装入(填酸式、碱式)滴定管进行滴定至终点,三次平行实验所消耗溶液体积依次为25.00mL、24.95mL、25.05mL,该绿矾样品的纯度为(用含w、c的代数式表示)。

已知:Ni3+的氧化性比稀HNO3强。
回答下列问题:
-
(1) 已知:Cr3++4OH-= CrO2-+2H2O。“一次碱析”时,需加入过量的NaOH溶液的目的是。
-
(2) “氨解”的目的为。
-
(3) “净化”“过滤”后得到含有两种元素的不溶性化合物,该化合物的化学式为,写出“氧化”中发生反应的离子方程式:。
-
(4) 从NiSO4溶液中得到硫酸镍晶体需经过“系列操作”为,,过滤,洗涤,干燥(填操作名称)。
-
(5) 1844年,科学家发现金属镍可以用NaH2PO2将水溶液中的Ni2+还原出来,NaH2PO2将转化为H3PO3 , 这一原理现用于化学镀镍。写出化学镀镍原理的离子方程式。
-
(6) 为测定硫酸镍晶体(NiSO4·n H2O)的组成,进行如下实验:称取2.63g样品,配成250.00mL溶液,准确量取配制的溶液25.00mL,用0.0400mol/L EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL。则硫酸镍晶体的化学式为。
 溶液中加入过量的2%稀氨水
C . 除去乙酸乙酯中的乙醇:向其中加入饱和
溶液中加入过量的2%稀氨水
C . 除去乙酸乙酯中的乙醇:向其中加入饱和  溶液进行多次萃取分液
D . 混有少量NaCl的
溶液进行多次萃取分液
D . 混有少量NaCl的  晶体提纯:将样品加入适量的水,加热至完全溶解、静置冷却、过滤
晶体提纯:将样品加入适量的水,加热至完全溶解、静置冷却、过滤
 B . 蒸发
B . 蒸发  C . 转移
C . 转移  D . 定容
D . 定容 
 溶液和.
溶液和.  .溶液中,一段时间后,在
.溶液中,一段时间后,在 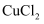 溶液中的铝片表面能观察到明显的反应现象
D . 用苯萃取溴水中的溴,有机层应从上口倒出
溶液中的铝片表面能观察到明显的反应现象
D . 用苯萃取溴水中的溴,有机层应从上口倒出
| A | B | C | D |
| | | | |
| 蒸发 | 过滤 | 蒸馏 | 分液 |
物质 | 熔点/℃ | 沸点/℃ | 密度 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 不溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
浓硫酸 | - | 338 | 1.84 | 易溶于水 |

实验步骤如下:
取100mL烧杯,用20mL浓硫酸与足量浓硝酸配制成混合酸,将混合酸小心地加入B中。把15.6g苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,使溶液混合均匀。在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水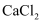 颗粒,静置片刻,弃去
颗粒,静置片刻,弃去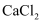 , 然后进一步提纯得到纯硝基苯17.22g。
, 然后进一步提纯得到纯硝基苯17.22g。
回答下列问题:
-
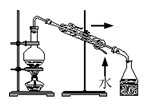
(1) 装置中仪器C的名称是;为了使反应在50~60℃下进行,常用的加热方式是。
-
(2) 将粗产品置于分液漏斗中加水,振荡后静置,产物应在(填“上”或“下”)层,在洗涤操作中,第二次水洗的作用是。
-
(3) 步骤中加入无水
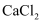 的目的是,进一步提纯采用的操作方法为。
的目的是,进一步提纯采用的操作方法为。
-
(4) 本实验所得到的硝基苯的产率为。

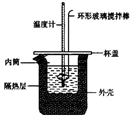

 溶液中提取
溶液中提取 







