物质的量浓度 知识点题库
把7.4g小苏打和Na2CO3·10H2O组成的混合物溶于水配成100 mL溶液,测得其中c(Na+)=0.6 mol/L。若将等质量的原混合物加热至恒量,则该混合物质量减少了( )
A . 5.28g
B . 4.22g
C . 3.18g
D . 2.12g
将9.58 g Na2CO3·10H2O与NaHCO3的混合物溶于水配成100mL溶液,测得c(Na+)=1mol/L。再取同质量的混合物,充分加热至质量不变时,所得固体的质量为:( )
A . 5.30g
B . 7.78g
C . 6.72g
D . 6g
下列溶液中Na+与50mL 3mol•L﹣1 NaCl溶液中Na+物质的量浓度相等的是( )
A . 150 mL 1 mol•L﹣1Na3PO4溶液
B . 75 mL 2 mol•L﹣1NaNO3溶液
C . 75 mL 3 mol•L﹣1Na2SO4溶液
D . 150 mL 2mol•L﹣1NaCl溶液
下列目的能达到的是( )
A . 将58.5 g NaCl溶于1 L水中可得1 mol•L﹣1的NaCl溶液
B . 从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L
C . 中和100 mL 1 mol/L的H2SO4溶液生成正盐,需NaOH 4 g
D . 将78 g Na2O2溶于水,配成1 L溶液可得到浓度为1 mol•L﹣1溶液
一定温度下,某在物质水中的溶解度为S,计算该温度下这种饱和溶液中溶质的物质的量浓度,必不可少的物理量是 ( )
①溶液中溶质的摩尔质量②溶液中溶质和溶剂的质量比③溶液的密度④溶液的体积.
A . ①②
B . ②③
C . ①③
D . ②④
下列溶液中Cl-浓度最大的是( )
A . 1000 mL 2.5 mol•L-1 NaCl 溶液
B . 250 mL 1 mol•L-1 AlCl3 溶液
C . 200 mL 2 mol•L-1 MgCl2 溶液
D . 300 mL 5 mol•L-1 KClO3 溶液
将1.52g铜镁合金完全溶解于50mL某浓度的硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),当向反应后的溶液中加入640mL 1.0mol/LNaOH溶液时,金属离子全部转化为沉淀,测得沉淀的质量为2.54g。下列说法正确的是( )
A . 该合金中铜与镁的物质的量之比是1:2
B . 该硝酸中HNO3的物质的量浓度是14.0mol/L
C . NO2和N2O4的混合气体中,NO2的体积分数是20%
D . 该硝酸中HNO3的质量分数为60%
在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为()
A . 2molL-1
B . 2.5molL-1
C . 5molL-1
D . 7.5molL-1
将一块铁片放入500mL, 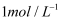 的CuSO4溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,反应后溶液中CuSO4的物质的量浓度是()
的CuSO4溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,反应后溶液中CuSO4的物质的量浓度是()
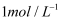 的CuSO4溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,反应后溶液中CuSO4的物质的量浓度是()
的CuSO4溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,反应后溶液中CuSO4的物质的量浓度是()
A . 0.9mol/L
B . 0.85mol/L
C . 0.8mol/L
D . 0.75mol/L
标准状况下VL氨气溶解在1L水里(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为  ,物质的量浓度c mol/L,则下列关系中错误的是()
,物质的量浓度c mol/L,则下列关系中错误的是()
 ,物质的量浓度c mol/L,则下列关系中错误的是()
,物质的量浓度c mol/L,则下列关系中错误的是()
A . ρ= 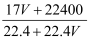 B .
B .  =
= 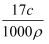 C .
C .  =
= 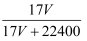 D . c=
D . c= 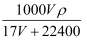
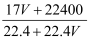 B .
B .  =
= 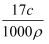 C .
C .  =
= 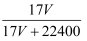 D . c=
D . c= 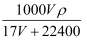
某同学血液化验单中“葡萄糖”的结果为5.04×10-3mol·L-1。这里的“5.04×10-3mol·L-1”表示葡萄糖的( )
A . 物质的量
B . 摩尔质量
C . 质量分数
D . 物质的量浓度
下列说法正确的是( )
A . 22g CO2含有0.5mol CO2分子,体积为11.2L
B . 3.2g O2和3.2g O3含氧原子的数目不相同
C . 3.01×1023个水分子的质量为9g
D . 1L 0.2mol/L CaCl2溶液中,Cl-数目为0.2×6.02×1023个
某一Na2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.5mol/L,SO42-的物质的量浓度为0.8 mol/L,则此溶液中Na+的物质的量浓度为( )
A . 0.1mol/L
B . 0.15 mol/L
C . 0.2 mol/L
D . 0.25 mol/L
某10%的 NaOH溶液,加热蒸发掉100g水后(无晶体析出)得到80mL 20%的NaOH溶液,则该20%的 NaOH溶液的溶质的物质的量浓度为( )
A . 6.25mol·L-1
B . 12.5mol·L-1
C . 7mol·L-1
D . 7.5mol·L-1
用20.0gNaOH固体溶于水配制成1L溶液。
-
(1) 计算所得溶液溶质的物质的量浓度?。
-
(2) 若从上述溶液中取出10mL用水稀释到500mL,所得溶液中溶质的物质的量浓度?。
浓度均为0.1mol·L-1的NaCl、CaCl2溶液等体积混合,下列说法错误的是( )
A . Na+和Ca2+混合前后的数目均不变
B . 混合前CaCl2溶液中c(Cl-)为0.2mol·L-1
C . 混合后溶液中c(Cl-)为0.3mol·L-1
D . 混合前NaCl、CaCl2溶液中c(Cl-)之比为1∶2
某溶液中所含离子的浓度如下表,则Mn+及a值可能分别为( )
| 离子 | | | H+ | Al3+ | Mn+ |
| 浓度(mol·L-1) | 3 | 4 | 2 | 2 | a |
A . Mg2+、1.5
B . Fe3+、0.5
C . Ba2+、1.5
D . K+、2.5
将0.6 mol Cl2通入过量的NaOH溶液中,产物中可能有NaCl、NaClO、NaClO3 , 且产物的成分与温度高低有关。
-
(1) n(NaCl)+n(NaClO)+n(NaClO3)=mol。
-
(2) 改变温度,产物中NaClO3的最大理论产量为mol。
-
(3) 若某温度下,反应后c(Cl-):c(
 )=8:1,则溶液中c(ClO-):c(
)=8:1,则溶液中c(ClO-):c(  ))=。
))=。
用8.70g
MnO2与100mL 36.5%密度为1.20g/cm3的浓盐酸共热(假设HCl没有损失且MnO2被完全消耗),请回答(要求写出运算过程)
-
(1) 求出浓盐酸的物质的量浓度
-
(2) 反应中生成的Cl2在标准状况下的体积。
三氯化氮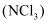 是一种强氧化剂,工业上可用于漂白和消毒。为准确测量某
是一种强氧化剂,工业上可用于漂白和消毒。为准确测量某 溶液的浓度,现量取20.00mL该溶液,置于100mL容量瓶中,用水稀释至刻度,摇匀。吸取25.00mL于烧杯中,加入足量
溶液的浓度,现量取20.00mL该溶液,置于100mL容量瓶中,用水稀释至刻度,摇匀。吸取25.00mL于烧杯中,加入足量 亚硫酸钠溶液,充分反应后,向烧杯中加入足量
亚硫酸钠溶液,充分反应后,向烧杯中加入足量 盐酸酸化的氯化钡溶液,得沉淀m g。已知:
盐酸酸化的氯化钡溶液,得沉淀m g。已知: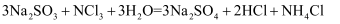 , 则测量的某
, 则测量的某 溶液的浓度是( )
溶液的浓度是( )
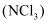 是一种强氧化剂,工业上可用于漂白和消毒。为准确测量某
是一种强氧化剂,工业上可用于漂白和消毒。为准确测量某 溶液的浓度,现量取20.00mL该溶液,置于100mL容量瓶中,用水稀释至刻度,摇匀。吸取25.00mL于烧杯中,加入足量
溶液的浓度,现量取20.00mL该溶液,置于100mL容量瓶中,用水稀释至刻度,摇匀。吸取25.00mL于烧杯中,加入足量 亚硫酸钠溶液,充分反应后,向烧杯中加入足量
亚硫酸钠溶液,充分反应后,向烧杯中加入足量 盐酸酸化的氯化钡溶液,得沉淀m g。已知:
盐酸酸化的氯化钡溶液,得沉淀m g。已知: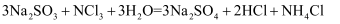 , 则测量的某
, 则测量的某 溶液的浓度是( )
溶液的浓度是( )
A . 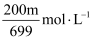 B .
B . 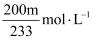 C .
C . 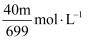 D .
D . 
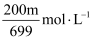 B .
B . 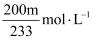 C .
C . 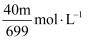 D .
D . 
最近更新





