物质的量浓度 知识点题库
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1 , c(SO42-)=0.8mol·L-1 , 则c(K+)为( )
A . 0.15 mol·L-1
B . 0.2 mol·L-1
C . 0.3 mol·L-1
D . 0.4 mol·L-1
把60mL 1mol/L NaCl溶液和40mL 0.5mol/L CaCl2溶液混合后,混合液中Cl﹣浓度为 .
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3 , 溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w= 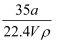 ×100%
×100%
②c= 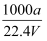
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w.
A . ①③
B . ②③
C . ①②
D . 只有②
实验室里需用480mL 0.1mol•L﹣1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
A . 称取7.68g硫酸铜,加入500mL水
B . 称取12.0g胆矾配成500mL溶液
C . 称取8.0g硫酸铜,加入500mL水
D . 称取12.5g胆矾配成500mL溶液
常温下,将30g 25%的NaOH溶液和20g 15% NaOH溶液混合,混合后溶液的密度为1.15g•cm﹣3 . 请计算(不整除的结果保留一位小数):
-
(1) 混合后溶液中NaOH的质量分数为;
-
(2) 混合后溶液中NaOH的物质的量浓度;
-
(3) 在1000g水中需要加入mol的NaOH恰好得到与(2)中浓度相同的溶液(忽略密度的变化)
下列溶液中含Cl﹣浓度最大的是( )
A . 10mL 0.1mol•L﹣1的氯化铝溶液
B . 10mL 0.2mol•L﹣1的氯化钙溶液
C . 30mL 0.2mol•L﹣1的氯化钾溶液
D . 40mL 0.25mol•L﹣1的氯化钠溶液
某盐的混合物中含有0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L Clˉ,则SO42ˉ为( )
A . 0.1mol/L
B . 0.2mol/L
C . 0.3mol/L
D . 0.4mol/L
将5mL0.4mol/LAgNO3溶液与10 mL 0.3mol/LBaCl2溶液混合。反应后,溶液中离子浓度最大的是( )
A . Cl-
B . NO3-
C . Ba2+
D . Ag+
用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A . 2.24 L CH4中含碳原子数目是0.1 NA
B . 0.1 mol·L-1 NaNO3溶液中含Na+数目是0.1 NA
C . 1 mol Cl2与足量的铁完全反应时得到的电子数目是2 NA
D . 标准状况下,22.4 L苯中含分子数目是NA
将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3 , 则此溶液的物质的量浓度(mol/L)为( )
A . Vρ/(MV+2240)
B . 1000Vρ/(MV+2240)
C . MV/(22.4(V+0.1) ρ
D . 1000VρM/(MV+2240)
下列溶液中c(Cl-) 最大的是( )
A . 10mL 0.1 mol·L-1的AlCl3溶液
B . 20mL 0.1 mol·L-1的CaCl2溶液
C . 30mL 0.2 mol·L-1的KCl溶液
D . 100mL 0.25 mol·L-1的NaCl溶液
有硫酸镁溶液500mL,它的密度是1.20g/cm3 , 其中镁离子的质量分数是4.8%,则有关该溶液的说法错误的是( )
A . 溶质的质量分数是24.0%
B . 硫酸根离子的质量分数是19.2%
C . 溶液的物质的量浓度是2.4mol/L
D . 溶质和溶剂的物质的量之比是1:40
某溶液中只含有  、
、  、
、  、
、  四种离子,已知前三种离子的个数比为
四种离子,已知前三种离子的个数比为  ,则溶液中
,则溶液中  和
和  的离子个数比为( )
的离子个数比为( )
 、
、  、
、  、
、  四种离子,已知前三种离子的个数比为
四种离子,已知前三种离子的个数比为  ,则溶液中
,则溶液中  和
和  的离子个数比为( )
的离子个数比为( )
A . 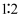 B .
B . 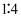 C .
C . 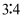 D .
D . 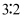
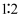 B .
B . 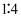 C .
C . 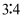 D .
D . 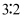
-
(1) 碳的氧化物可用来制备碳酰肼[
 ,其中碳元素为
,其中碳元素为 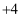 价].加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳.该反应的化学方程式为.
价].加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳.该反应的化学方程式为.
-
(2) 控制城市空气污染源的方法可以有_________(多选)A . 开发新能源 B . 使用电动车 C . 植树造林 D . 戴上呼吸面具
-
(3)
 有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称.如消除采矿业胶液中的氰化物(如
有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称.如消除采矿业胶液中的氰化物(如 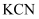 ),经以下反应实现:
),经以下反应实现:  ,则生成物A的化学式为.
,则生成物A的化学式为.
-
(4) 火法炼铅的废气中含低浓度
 ,可将废气通入过量氨水中进行处理,反应的离子方程式为.
,可将废气通入过量氨水中进行处理,反应的离子方程式为.
-
(5) 取
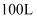 某钛液,加铝粉,使其发生反应
某钛液,加铝粉,使其发生反应  (未配平),反应消耗铝
(未配平),反应消耗铝 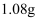 ,则该钛液中
,则该钛液中  的物质的量浓度为.
的物质的量浓度为.
-
(6) 工业上利用纳米
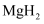 和
和 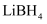 组成的体系储放氢(如图所示).写出放氢过程中发生反应的化学方程式:.
组成的体系储放氢(如图所示).写出放氢过程中发生反应的化学方程式:. 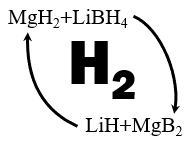
-
(7) 工业上可以采用热还原法制备金属镁(沸点107℃,熔点648.8℃).将碱式碳酸镁
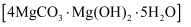 和焦炭按一定比例混合,放入真空管式炉中先升温至700℃保持一段时间,然后升温至1450℃反应制得镁(同时生成可燃性气体).
和焦炭按一定比例混合,放入真空管式炉中先升温至700℃保持一段时间,然后升温至1450℃反应制得镁(同时生成可燃性气体). 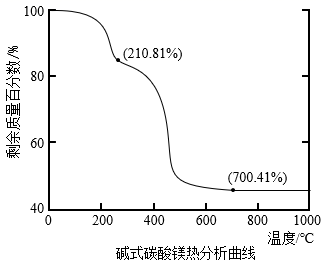
①用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是.
②碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学方程式:.
对1 mol·L-1的BaCl2溶液的有关叙述中,正确的是( )
A . 该溶液中Cl-浓度为2 mol·L-1
B . 该溶液中Ba2+的物质的量是1 mol
C . 可使用250 mL容量瓶分两次完成490 mL该浓度的BaCl2溶液的配制
D . 将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol·L-1
下列叙述正确的是( )
A . 1 mol·L-1的硫酸钠溶液中含有钠离子个数为NA
B . 标准状况下,22.4 L SO3中含有的原子数目为3NA
C . 40 g NaOH溶解于1 L水中,形成溶液中溶质的物质的量浓度是1 mol·L-1
D . 32g氧气的物质的量为1mol
在标准状况下,将O2和NO2按体积比1∶4充满一干燥的烧瓶,将烧瓶倒置于水中,瓶内液面逐渐上升。最后烧瓶内溶液中溶质的物质的量浓度是( )
A . 0.045 mol·L-1
B . 0.036 mol·L-1
C . 0.026 mol·L-1
D . 0.028 mol·L-1
下列各溶液中,Cl-物质的量浓度最小的是( )
A . 3L 0.4mol·L-1 KCl溶液
B . 4L 0.5mol·L-1 MgCl2溶液
C . 2L 0.3mol·L-1 AlCl3溶液
D . 6L 0.3mol·L-1 NaCl溶液
在国际单位制中,以下物理量为基本物理量的是( )
A . 物质的量
B . 物质的量浓度
C . 气体摩尔体积
D . 摩尔质量
下列溶液中,Na+物质的量浓度最大的是( )
A . 10 mL 0.4 mol/L NaOH溶液
B . 20 mL 0.3 mol/L Na3PO4溶液
C . 30 mL 0.3 mol/L Na2SO4溶液
D . 40 mL 0.5 mol/L NaNO3溶液
最近更新



