物质的量浓度 知识点题库
将10.6gNa2CO3溶于水配成1L溶液.
-
(1) 该溶液中Na2CO3的物质的量浓度为,溶液中Na+的物质的量浓度为
-
(2) 向该溶液中加入一定量的NaCl 固体,使溶液中Na+ 的物质的量浓度为0.4mol•L﹣1(假设溶液体积不变)需加入NaCl的质量为,Cl﹣ 的物质的量浓度为.
现有0.284kg质量分数为10%的Na2SO4溶液.计算:
-
(1) 溶液中Na2SO4的物质的量.
-
(2) 溶液中Na+的物质的量.
-
(3) 若将溶液稀释到2L,求溶液中Na+的物质的量浓度.
浓度为0.1mol/L的HCl溶液VmL,加水稀释到2VmL,取出10mL,这10mL溶液中含有c(H+)( )
A . 0.5mol/L
B . 0.01mol/L
C . 0.02mol/L
D . 0.05mol/L
在100g浓度为10mol•L﹣1、密度为ρ g•cm﹣3的氨水中加入一定量的水稀释成5mol•L﹣1的氨水,则加入水的体积为( )
A . 小于100 mL
B . 等于100 mL
C . 大于100 mL
D . 等于(100/ρ)mL
某盐的混合物中含有0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L Cl﹣ , 则SO42﹣为( )
A . 0.1 mol/L
B . 0.2 mol/L
C . 0.3 mol/L
D . 0.4 mol/L
在50mL NaNO3和Na2SO4的混合溶液中,c (Na+)=1mol/L,往其中加入适量BaCl2溶液恰好完全反应,得到2.33g白色沉淀,则原混合溶液中c (NO3﹣)=mol/L.
现将200mL0.01mol/LNaOH与50mL某浓度的Ca (OH)2溶液混合(混合后体积变化忽略不计),所得溶液中OH﹣的物质的量浓度是0.016mol/L,则Ca(OH)2溶液的物质的量浓度是mol/L.
如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

A . 该硫酸试剂的物质的量浓度为18.4 mol/L
B . 稀释该硫酸时应把水倒入硫酸中,边倒边搅拌
C . 50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol
D . 标准状况下2.7 g Al与足量的该硫酸反应可得到H2 3.36 L
V L Fe2(SO4)3溶液中含Fe3+m g,则该溶液中Fe3+的物质的量浓度为mol•L﹣1 , 溶质的物质的量浓度为 mol•L﹣1 .
下列说法中正确的是( )
A . 同温同压下,相同体积的两物质,它们的物质的量必相等
B . 任何条件下,等物质的量的氮气和一氧化碳所含的分子数必相等
C . 1L一氧化碳气体的质量一定比1L氧气的质量要小
D . 等体积、等物质的量浓度的强酸中所含的H+数一定相等
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的物质的量浓度为( )
A . (b-a)/Vmol/L
B . (2b-a)/V mol/L
C . 2(b-a)/V mol/L
D . 2(2b-a)/V mol/L
把500  有
有  和
和  的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含 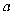
 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 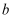
 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
 有
有  和
和  的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含 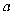
 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 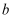
 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
A . 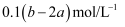 B .
B .  C .
C . 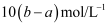 D .
D . 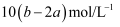
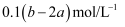 B .
B .  C .
C . 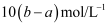 D .
D . 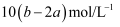
在VmL硫酸铝溶液中含有a g 的Al3+ , 取该溶液V/10mL,用水稀释至10V mL,则稀释后溶液中SO42-的物质的量浓度为( )
A . 5a/9v mol·L-1
B . 10a/9v mol·L-1
C . 10a/27v mol·L-1
D . 20a/v mol·L-1
下列溶液中的Cl-浓度与50 mL 1 mol ·L-1 MgCl2溶液中的Cl-浓度相等的是( )
A . 100 mL 1 mol·L-1 NaCl溶液
B . 25 mL 1 mol·L-1 Ca(ClO)2溶液
C . 100 mL 2 mol·L-1 KCl溶液
D . 25 mL 1 mol ·L-1 AlCl3溶液
配制250mL
1.0mol/LH2SO4溶液,需要18mol/L H2SO4溶液的体积是多少?
下列溶液中溶质的物质的量浓度为1 mol·L-1的是 ( )
A . 将58.5 g NaCl溶解于1 L水中配成的溶液
B . 将40g NaOH溶于水并配成1 L溶液
C . 将0.5 mol·L-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D . 含K+为2 mol的K2SO4溶液
将Na2CO3和NaHCO3的混合物加热,生成的气体(假设无损耗)全部通入足量的石灰水中,得到20.0g白色沉淀,加热后的残留物加入200mL盐酸恰好完全反应,生成5.60LCO2气体(标准状况下)。试回答下列问题(计算结果均保留3 位有效数字)
-
(1) 加热时发生反应的化学方程式为。
-
(2) 所加盐酸的物质的量浓度为mol/L。
将标准状况下的aLHCl气体溶于1000g水中,得到盐酸密度为bg/cm3 , 则该盐酸的物质的量浓度是( )
A . 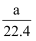 mol•L-1
B .
mol•L-1
B . 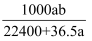 mol•L-1
C .
mol•L-1
C . 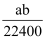 mol•L-1
D .
mol•L-1
D . 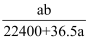 mol•L-1
mol•L-1
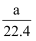 mol•L-1
B .
mol•L-1
B . 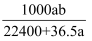 mol•L-1
C .
mol•L-1
C . 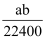 mol•L-1
D .
mol•L-1
D . 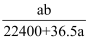 mol•L-1
mol•L-1
根据计算填空:
-
(1) 6.02×1022个HCl分子的物质的量为,该气体溶于水配制成100 mL的溶液,则溶液中Cl-的物质的量浓度为。
-
(2) 标准状况下体积为4.48LO2与g Cl2所含的物质的量相同。
NA 为阿伏加德罗常数的值。下列说法正确的是( )
A . 含有 NA 个原子的氢气在标准状态下的体积约为 22.4L
B . 0.1molNH  中含有的质子数为 NA
C . 0.5mol·L-1NaCl 溶液中含有 0.5molNa+
D . 常温常压下,64gSO2 中含有的原子数为 3NA
中含有的质子数为 NA
C . 0.5mol·L-1NaCl 溶液中含有 0.5molNa+
D . 常温常压下,64gSO2 中含有的原子数为 3NA
 中含有的质子数为 NA
C . 0.5mol·L-1NaCl 溶液中含有 0.5molNa+
D . 常温常压下,64gSO2 中含有的原子数为 3NA
中含有的质子数为 NA
C . 0.5mol·L-1NaCl 溶液中含有 0.5molNa+
D . 常温常压下,64gSO2 中含有的原子数为 3NA
最近更新



