电解质溶液的导电性 知识点题库
(1)上述十种物质中,属于电解质的有 ,属于非电解质的有 .
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH﹣=H2O,该反应的化学方程式为 .
(3)除去③中少量②的操作是 ,化学方程式为 .
(4)标准状况下, L ④中含有0.4mol 氧原子.
(5)现有100mL⑩溶液中含Fe3+5.6g,则溶液中SO42﹣的物质的量浓度是 .
(6)若在⑦中缓慢加入⑥,产生的现象是 .
(7)将①加入到⑧中,⑧的导电能力变化为 (填“增强”、“减弱”或“基本不变”).
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
 的
的  ,
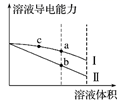
,  溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( ) 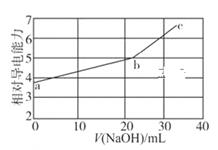
 与
与  的导电能力之和大于
的导电能力之和大于  的
C . b点的混合溶液
的
C . b点的混合溶液  D . c点的混合溶液中,
D . c点的混合溶液中, 
 B .
B . 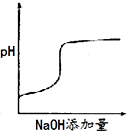 C .
C . 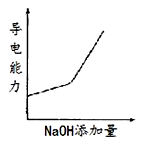 D .
D . 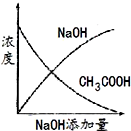
-
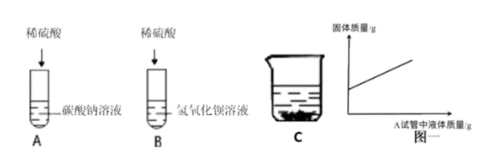
(1) B试管中发生反应的离子方程式为 。
-
(2) 实验一]A、B试管中物质分别充分反应后,先将 B 试管中所有物质倒入空烧杯 C 中,再将 A 试管中所得溶液慢慢滴加到 C 烧杯中,烧杯内固体质量随 A 试管中加入液体质量变化如图所示:据此判断 B 试管中反应后所得溶液中的溶质是 (填化学式);
-
(3) [实验二]将 C 烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,观察到 的实验现象,进而证明滤渣为混合物;
-
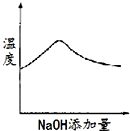
(4) 向Ba(OH)2溶液中滴加稀H2SO4反应至过量,导电能力随时间变化的曲线图为 。
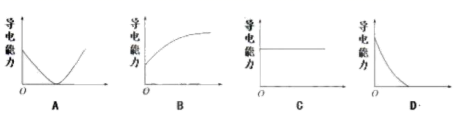
若将稀硫酸改为等浓度的Na2SO4 溶液,测得的溶液的导电性曲线是否与上述曲线相同是否一致?(是或否);并说明理由。
-
(1) 能够导电的是。
-
(2) 属于电解质的是。
-
(3) 属于非电解质的是。
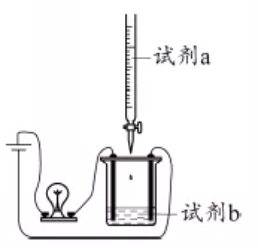
| 选项 | A | B | C | D |
| 试剂a | CuSO4 | NH4HCO3 | H2SO4 | CH3COOH |
| 试剂b | Ba(OH)2 | Ca(OH)2 | Ba(OH)2 | NH3·H2O |
-
(1) Ⅰ、现有下列物质:①
 晶体 ②熔融
晶体 ②熔融  ③石墨 ④稀硫酸 ⑤
③石墨 ④稀硫酸 ⑤  溶液⑥液态氯化氢 ⑦酒精 ⑧氨水 ⑨
溶液⑥液态氯化氢 ⑦酒精 ⑧氨水 ⑨  ⑩澄清石灰水。回答下列问题:
⑩澄清石灰水。回答下列问题: 上述状态下可导电的是(填序号),属于电解质的是(填序号)。
-
(2) 写出
 、
、  在水溶液中的电离方程式。
在水溶液中的电离方程式。
-
(3) ⑤与少量的⑩的离子反应方程式是
-
(4) Ⅱ、某同学称取一定量的固体配成溶液,在该溶液中先加入一定量的稀盐酸,然后逐滴加入
 溶液(如图甲所示)滴加过程中生成沉淀的质量与加入
溶液(如图甲所示)滴加过程中生成沉淀的质量与加入  溶液的体积的关系如图乙所示。请回答下列问题:
溶液的体积的关系如图乙所示。请回答下列问题: 
溶解
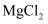 固体所用的玻璃仪器有(填字母)。
固体所用的玻璃仪器有(填字母)。a、托盘天平 b、烧杯 c、漏斗 d、玻璃棒
-
(5)
 段发生反应的离子方程式为;
段发生反应的离子方程式为;
-
(6) 在
 点对应的溶液中滴加
点对应的溶液中滴加  溶液,观察到的现象是,发生反应的离子方程式为。
溶液,观察到的现象是,发生反应的离子方程式为。

 HA+OH-
HA+OH-
① ②
②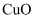 ③熔融
③熔融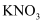 ④盐酸 ⑤葡萄糖溶液⑥
④盐酸 ⑤葡萄糖溶液⑥ ⑦
⑦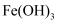 胶体 ⑧
胶体 ⑧ ⑨细铁丝 ⑩
⑨细铁丝 ⑩
-
(1) 上述物质能导电的有(填序号,下同),属于电解质的有。
-
(2) 请写出②与④反应的化学方程式。
-
(3) 胶体是一类重要的分散系,请写出实验室制备⑦的化学方程。
-
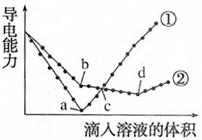
(4) 向⑩的水溶液中逐滴滴加⑧的水溶液,溶液的导电能力变化曲线如图中的(填字母),当溶液恰好呈中性时
 与
与 的物质的量之比为。
的物质的量之比为。
①氧气 ②二氧化碳 ③氯化氢 ④氯气 ⑤一氧化氮 ⑥氨气 ⑦二氧化硫
回答下列问题:
-
(1) 上述物质中溶于水能导电的非电解质是(填序号)。
-
(2) 上述两种无色气体相遇易产生白烟的是(填序号)。
-
(3) 写出铜和稀
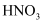 反应产生一氧化氮的化学方程式。用双线桥表示下列反应电子转移的方向和数目:
反应产生一氧化氮的化学方程式。用双线桥表示下列反应电子转移的方向和数目:

-
(4) 上述气体中(填序号)能使品红溶液褪色,在通常状况下,将这两种气体等体积同时通入紫色石蕊试液中,观察到的现象是,其原因是(用离子方程式表示)。
-
(5) 二氧化碳(填“能”或“不能”)形成酸雨,理由是。

 和
和 生成
B . 钠和液氨可发生反应:
生成
B . 钠和液氨可发生反应: C . 蒸发钠的液氨溶液,蓝色会逐渐褪去
D . 0.1mol钠投入液氨中生成0.01mol
C . 蒸发钠的液氨溶液,蓝色会逐渐褪去
D . 0.1mol钠投入液氨中生成0.01mol 时,Na共失去0.02mol电子
时,Na共失去0.02mol电子



