电解质溶液的导电性 知识点题库
下列叙述中,正确的是( )
A . 强电解质的导电性一定比弱电解质的导电性强
B . 溶解度小的物质的导电性一定比溶解度大的物质的导电性弱
C . 金属元素从化合态变为游离态时,该元素一定被还原
D . 金属阳离子得电子多时氧化性强
(1)下列物质中能导电的是 ,属于强电解质的是 ,
①H2SO4 , ②熔融硫酸钠,③NH3•H2O,④CO2 , ⑤碳酸钙,⑥CH3COOH,⑦氯气,⑧石墨.
(2)某温度下,将50mL 0.2mol/L MgCl2溶液与50mL 0.2mol/LNaOH溶液充分混合.经判断: (选填有或无)沉淀生成,依据是 已知此温度下(KSP[Mg(OH)2]=1.8×10﹣12)
(3)常温下,0.1mol•L﹣1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32﹣)(填“>”、“=或“<”),原因是 (用恰当的化学用语和必要的文字说明回答).
下列说法正确的是( )
A . HClO是弱酸,所以NaClO是弱电解质
B . HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
C . 1.00 mol NaCl中含有6.02×1023个NaCl分子
D . 纯净矿泉水、铝热剂、漂白粉均为混合物
下列说法正确的是( )
A . 导电性强的溶液一定是强电解质溶液
B . H2SO4是强电解质,稀硫酸中没有H2SO4分子
C . NaCl晶体是由Na+和Cl﹣组成,NaCl晶体是良导体
D . 氯气和氨气的水溶液导电性都很好,所以它们是强电解质
现有下列八种物质:①NaOH溶液 ②铁丝 ③液态HCl④熔融氯化钠 ⑤硫酸钠固体⑥CO2 ⑦酒精⑧生石灰。
-
(1) 上述物质中,可导电的是(填序号,下同)。
-
(2) 上述物质中,属于非电解质的是。
-
(3) 上述物质中,属于电解质但不导电的是。
下列说法中不正确的是( )
①将硫酸钡放入水中不能导电,所以硫酸钡是非电解质;②氨溶于水得到溶液氨水能导电,所以氨水是电解质;③固态HCl不导电,熔融态的HCl可以导电;④NaHSO4电离时生成的阳离子有氢离子,所以是酸;⑤电解质放在水中一定能导电,非电解质放在水中一定不导电。
A . ①④
B . ①④⑤
C . ①②③④
D . ①②③④⑤
下列图示与对应的叙述相符合的是( )
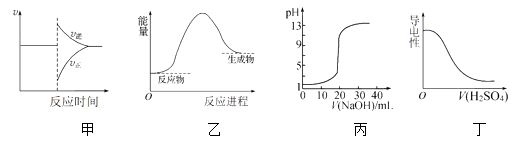
A . 图甲表示对某化学平衡体系改变温度后反应速率随时间的变化
B . 图乙表示反应物断键吸收的能量大于生成物成键放出的能量
C . 图丙表示0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1硫酸时溶液pH的变化
D . 图丁表示向Ba(OH)2溶液中滴加稀H2SO4至过量,溶液的导电性变化情况
下列关于氯化钠的说法正确的是( )
A . 氯化钠是由氯化钠分子构成的
B . 液态不导电,水溶液能导电
C . 质软,固态能导电
D . 属于离子晶体
用一定浓度 NaOH 溶液滴定某醋酸溶液。滴定终点附近溶液 pH 和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点;溶液总体积变化忽略不计)。下列说法不正确的是( )

A . a 点对应的溶液中:c(CH3COO-) = c(Na+)
B . a→b 过程中,n(CH3COO-)不断增大
C . c→d 溶液导电性增强的主要原因是 c(OH-)和 c(Na+)增大
D . 根据溶液 pH 和导电能力的变化可判断:V2<V3
下列图示与对应叙述相符的是( )

A . 图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化
B . 图②表示压强对可逆反应A(g)+2B(g)  3C(g)+D(s)的影响,乙的压强比甲的压强大
C . 图③中曲线表示反应3A(g) + B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
C . 图③中曲线表示反应3A(g) + B(g)  2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D . 据图④,若要除去CuSO4溶液中的Fe3+ , 可加入NaOH溶液至pH在4左右
2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D . 据图④,若要除去CuSO4溶液中的Fe3+ , 可加入NaOH溶液至pH在4左右
 3C(g)+D(s)的影响,乙的压强比甲的压强大
C . 图③中曲线表示反应3A(g) + B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
C . 图③中曲线表示反应3A(g) + B(g)  2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D . 据图④,若要除去CuSO4溶液中的Fe3+ , 可加入NaOH溶液至pH在4左右
2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D . 据图④,若要除去CuSO4溶液中的Fe3+ , 可加入NaOH溶液至pH在4左右
下列物质属于非电解质,但其水溶液能导电的是( )
A . BaSO4
B . SO2
C . NaOH
D . Cl2
有以下十种物质:①稀H2SO4 ②纯醋酸(CH3COOH) ③NaOH溶液 ④FeCl3固体 ⑤CaCO3固体 ⑥CO2 ⑦熔融NaHSO4 ⑧Ba(HCO3)2溶液 ⑨乙醇(C2H5OH) ⑩NH3•H2O
请回答下列问题
-
(1) 其中能导电的是;其中属于非电解质的是;属于弱电解质的是。(填序号)
-
(2) 将题中④物质溶于水配成饱和溶液,滴入沸水中,继续煮沸至出现红褐色可制得Fe(OH)3胶体,写出该过程的化学方程式。
-
(3) 按要求写出题中各物质发生反应的离子方程式
①与⑧反应;
②的水溶液与⑤的反应;
③与⑦的水溶液的反应。
仅能在水溶液中导电的电解质是 ( )
A . NH3
B . C2H5OH
C . NaHCO3
D . NaOH
在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )

A . 盐酸中逐滴加入氢氧化钠溶液
B . 硫酸铜溶液中逐滴加入氢氧化钡溶液
C . 硫酸中逐滴加入氯化钡溶液
D . 盐酸中逐滴加入硝酸银溶液
下列说法正确的是( )
A . 石英、C60、金刚石都是原子晶体
B . H2O汽化成水蒸气、分解为H2和O2 , 都需要破坏共价键
C . H2SO4、NaOH的水溶液都能导电,所以它们都属于离子化合物
D . Cl2和PCl5分子中,氯原子的最外电子层都含有8个电子
相同体积的溶液:稀硫酸溶液a, 醋酸溶液b, 氢氧化钠溶液c 三者的导电能力相同,若分别加入体积和物质的量浓度都相同的NaCl溶液后,它们的导电能力强弱顺序是( )
A . b>a>c
B . a=b=c
C . c>a>b
D . b>c=a
回答下列有关醋酸的问题。
-
(1) Ⅰ.在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如下图所示:

加水量为0时,导电能力也为0,请解释原因:。
-
(2) a、b、c三点醋酸电离程度由大到小的顺序为;a、b、c三点对应的溶液中,pH最小的是;a、b、c三点对应的溶液中,水的电离程度最大的是。
-
(3) 在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.

-
(4) Ⅱ.常温下,有HCl、H2SO4、CH3COOH三种溶液,请用化学符号填空:
等体积、等物质的量浓度三种酸溶液,中和NaOH的能力由大到小的顺序是。
-
(5) 当三种酸溶液c(H+)相同时,写出物质的量浓度最大的酸与氢氧化钾反应的离子方程式。
-
(6) pH=1的HCl溶液与0.04 mol/L的Ba(OH)2溶液等体积混合后溶液pH是。
为了认识和研究的方便,对于数以万计的物质,人们常根据物质的组成、结构和性质或用途进行分类,运用分类法,可以发现物质及其变化的规律,预测物质的性质及可能发生的变化。就下列所列物质,按要求回答问题:
①食盐 ②食醋 ③氯化钠固体 ④BaSO4固体 ⑤纯CH3COOH ⑥KHSO4 ⑦Ba(OH)2⑧Na2O ⑨CO2 ⑩次氯酸HClO ⑪乙醇 ⑫HNO3 ⑬CuSO4•5H2O ⑭Cu2(OH)2CO3 ⑮Cu ⑯Fe(OH)3胶体
-
(1) 以上物质能导电的有(填序号)。
-
(2) 以上物质属于电解质的正盐的有(填序号)。
-
(3) 属于一元弱酸的有(填序号)。
-
(4) 写出⑥在熔融状态的电离方程式:。
-
(5) 写出NaHCO3在水溶液条件下的电离方程式:。
-
(6) 不定相选择:下列有关分散系的表述错误的是_______A . 分散系是多组分混合而成的一种稳定体系。 B . 分散质和分散剂是相对的概念,如75%的酒精,分散质既可以是酒精也可以是水。 C . 按照物质所处的状态划分(气、液、固三态),分散系可以分为9种。 D . 按照分散质粒子的直径大小,分散系可以分为溶液、胶体、浊液。 E . 胶体是一种特殊的分散系,如氯化钠无论溶解在水中还是溶解在酒精中都不可形成胶体。
由下图得出的结论正确的是( )

A . NaCl溶液能导电,是电解质
B . 电解质在电流的作用下才能发生电离
C . 固体NaCl中不存在 和
和 D . NaCl溶液中存在自由移动的水合钠离子和水合氯离子
D . NaCl溶液中存在自由移动的水合钠离子和水合氯离子
 和
和 D . NaCl溶液中存在自由移动的水合钠离子和水合氯离子
D . NaCl溶液中存在自由移动的水合钠离子和水合氯离子
下列化学用语的表述正确的是( )
A .  原子的价电子构型:
原子的价电子构型:
 B . 二氧化碳分子的比例模型:
B . 二氧化碳分子的比例模型:
 C .
C .  溶液导电:NaCl
溶液导电:NaCl
 Na++Cl-
D .
Na++Cl-
D .  的电子式:
的电子式:

 原子的价电子构型:
原子的价电子构型:
 B . 二氧化碳分子的比例模型:
B . 二氧化碳分子的比例模型:
 C .
C .  溶液导电:NaCl
溶液导电:NaCl
 Na++Cl-
D .
Na++Cl-
D .  的电子式:
的电子式:

最近更新



