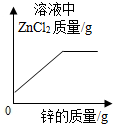
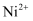氧化还原反应 知识点题库
在下列反应中:
a.2F2+2H2O===4HF+O2
b.2Na+2H2O===2NaOH+H2↑
c.CaO+H2O===Ca(OH)2
d.2H2O 2H2↑+O2↑
2H2↑+O2↑
-
(1) 水只作氧化剂的是(填字母序号,下同),水只作还原剂的是,水既作氧化剂又作还原剂的是,水既不作氧化剂又不作还原剂的是。
-
(2) 用双线桥法表示D反应中电子转移情况。
。
____Cr2O 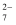 +____Cl﹣+____H+=____Cl2↑+____Cr3++____□,下列有关叙述不正确的是( )
+____Cl﹣+____H+=____Cl2↑+____Cr3++____□,下列有关叙述不正确的是( )
 参加反应,产生氯气物质的量是0.5mol
参加反应,产生氯气物质的量是0.5mol
-
(1) 古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
-
(2)
硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
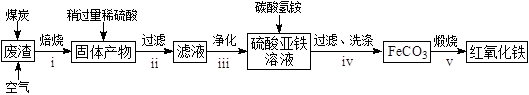
回答下列问题:
①在步骤i中产生的有毒气体可能有。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10−32 , 此时理论上将Al3+沉淀完全,则溶液的pH为。
③步骤iv中,生成FeCO3的离子方程式是。
-
(3) 氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释。
-
(4)
①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN− , 方案如下:
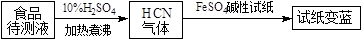
若试纸变蓝则证明食品中含有CN− , 请解释检测时试纸中FeSO4的作用。
-
(1) NO气体的体积为L,NO2气体的体积为L.
-
(2) 待产生的气体全部逸出后,向溶液中加入V mL a mol•L﹣1NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol•L﹣1 .

-
(1) 氯气有毒,一旦泄露会造成对空气的严重污染。工业上常用浓氨水检验氯气管是否漏气。(已知Cl2可将NH3氧化成N2)写出有关的化学方程式。
-
(2) 亚氯酸钠(NaClO2)是一种漂白剂。 已知NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是。
-
(3) 从海水中提取溴,一般要经过浓缩、氧化和提取三个步骤。氧化时常用氯气做氧化剂,写出有关的离子方程式。海带提碘时,由于碘的量较少,在灼烧、溶解之后得到的溶液用硝酸银溶液很难检验。设计一个检验溶液中是否含有碘离子的方法。
-
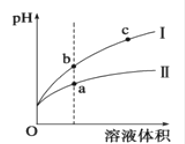
(4) 盐酸和醋酿都是元酸,某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如下图所示。据图判断盐酸稀释时的pH变化曲线为 (填“I”或“II”),溶液的导电性b c(填“>”、“<”或“=”)。水电离的[H+]a点比b点大还是小?从电离平衡移动原理解释原因
①铁和水蒸气反应 ②过氧化钠和水反应 ③氯气和水反应 ④二氧化氮和水反应



 中的氧化产物分别是
中的氧化产物分别是  、
、  、
、  B . 根据以上方程式可以得到氧化性:
B . 根据以上方程式可以得到氧化性:  C . 在反应
C . 在反应  中当1 mol
中当1 mol  参加反应时,2 mol HCl被氧化
D . 可以推理得到
参加反应时,2 mol HCl被氧化
D . 可以推理得到 
 →BaSO4
→BaSO4
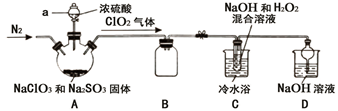
I.查阅资料:
①ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl。
Ⅱ.制备与分离:
-
(1) 实验加药品前应进行的实验操作是。
-
(2) 盛放NaClO3和Na2SO3固体的仪器名称是。
-
(3) 装置A中参加反应的氧化剂与还原剂的物质的量之比为。
-
(4) B装置的作用是。
-
(5) 若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②的内容。
①减压,55℃蒸发结晶; ②;
③用38℃~60℃热水洗涤; ④在38℃~60℃间进行干燥,得到成品。
-
(6) 装置D是处理尾气,反应的化学方程式。
-
(7) 实验结束后,继续通入一段时间N2的目的是。
-
(8) Ⅲ.测量与计算:
利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.4450g配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4 , 再滴加几滴淀粉溶液,(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O  =S4O
=S4O  +2I-)。
+2I-)。①滴定终点的现象是。
②下列滴定操作会导致测量结果偏低的是(填字母)。
a 锥形瓶洗涤后没有干燥 b 滴定时锥形瓶中有液体溅出
c 滴定终点时俯视读数 d 滴定管滴定前有气泡,滴定后气泡消失
③样品中NaClO2·3H2O的纯度为%(用含c、v的代数式表示)。
 ,还含有一定量的
,还含有一定量的  、
、  、
、  、
、 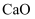 、
、  等)制备草酸钴晶体
等)制备草酸钴晶体  的工业流程如下图所示。请回答下列问题:
的工业流程如下图所示。请回答下列问题: 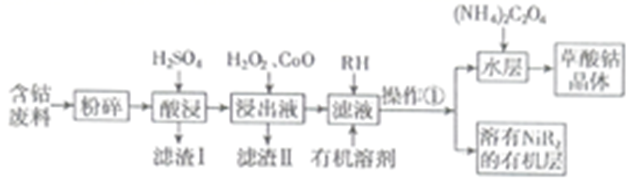
已知:①草酸钴晶体难溶于水
② 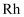 为有机物(难电离)
为有机物(难电离)
③相关金属离子 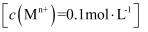 形成氢氧化物沉淀的
形成氢氧化物沉淀的  范围如下:
范围如下:
| 金属离子 | | | | |
| 开始沉淀的 | 7.5 | 2.7 | 3.4 | 6.9 |
| 沉淀完全的 | 9.0 | 3.7 | 4.7 | 8.9 |
-
(1) 滤渣Ⅰ的成分。
-
(2)
 是一种绿色氧化剂,写出加入
是一种绿色氧化剂,写出加入  后溶液中发生的主要反应的离子方程式。
后溶液中发生的主要反应的离子方程式。
-
(3) 加入氧化钴调节浸出液的
 的范围是。
的范围是。
-
(4) 加入有机溶剂的目的是。
-
(5) 若仅从沉淀转化角度考虑,能否利用反应
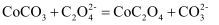 将
将 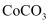 转化为
转化为  (填“能”或“不能”),说明理由:。(已知
(填“能”或“不能”),说明理由:。(已知  ,
,  )
)
-
(6) 为测定制得的草酸钴晶体样品的纯度,现称取样品
 ,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液
,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液  。移取
。移取 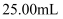 该溶液加入过量的稀硫酸酸化,用
该溶液加入过量的稀硫酸酸化,用 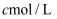 高锰酸钾溶液滴定,当溶液由(填颜色变化),消耗高锰酸钾溶液
高锰酸钾溶液滴定,当溶液由(填颜色变化),消耗高锰酸钾溶液 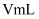 ,计算草酸钴晶体样品的纯度为
,计算草酸钴晶体样品的纯度为 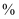 。(用含
。(用含 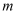 、
、 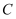 、
、 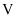 的代数式表示)(已知
的代数式表示)(已知  的摩尔质量为
的摩尔质量为 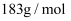 )
)
-
(1) 生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式
-
(2) 火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑。其中还原产物是。
-
(3) 中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是,其中 H2S在该反应中 (填标号)。
A.作氧化剂
B.作还原剂C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂 -
(4) 砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3 , 显示出来的性质是(填“还原性”或“氧化性”)。
-
(1) 下列微粒:①S②SO
 ③Fe2+④Al3+⑤Na⑥HCl⑦Na2O2。在化学反应中只能被氧化的是(填序号),只能表现出氧化性的是(填序号)。
③Fe2+④Al3+⑤Na⑥HCl⑦Na2O2。在化学反应中只能被氧化的是(填序号),只能表现出氧化性的是(填序号)。
-
(2) 高铁酸钠(Na2FeO4)(其中氧元素是-2价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O。
①用双线桥法在化学方程式中标出电子转移的情况。
②当反应中有5个FeO
 离子生成时,转移的电子数是个。
离子生成时,转移的电子数是个。 -
(3) 请完成方程式的配平。Al+NO
 +OH-=AlO
+OH-=AlO  +N2↑+H2O
+N2↑+H2O
-
(4) 在一定条件下,2个X2O
 离子恰好能把6个SO
离子恰好能把6个SO  离子氧化成SO
离子氧化成SO  ,则还原产物中X元素的化合价为。
,则还原产物中X元素的化合价为。
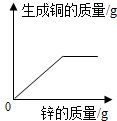 B .
B . 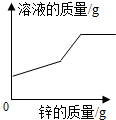 C .
C . 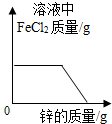 D .
D .