氧化还原反应 知识点题库
二氧化氯(ClO2)能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2 , 下列说法正确的是( )
A . 被氧化的元素是氯元素
B . 氧化产物与还原产物的物质的量之比为1:1
C . 消耗1mol还原剂,转移5 mol电子
D . 净化1 L含CN﹣1.04 mg•L﹣1的废水,理论上需用2×10﹣5mol ClO2
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿按一定比例混合加热可制得铜2Cu2S+Cu2O  6Cu+SO2↑.对于该反应,下列说法中正确的是( )
6Cu+SO2↑.对于该反应,下列说法中正确的是( )
 6Cu+SO2↑.对于该反应,下列说法中正确的是( )
6Cu+SO2↑.对于该反应,下列说法中正确的是( )
A . 该反应中的氧化剂是Cu2O
B . 氧化产物和还原产物的物质的量之比为1:6
C . Cu既是氧化产物又是还原产物
D . Cu2S在反应中仅做氧化剂
吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是( )
A . 还原剂
B . 氧化剂
C . 既是氧化剂又是还原剂
D . 以上均不是
从氧化还原的角度分析水在下列化学反应中只做还原剂的是 ( )
A . 电解水
B . 钠和水的反应2Na+2H2O═2NaOH+H2↑
C . 氟气和水反应2F2+2H2O═4HF+O2
D . 氯气和水反应Cl2+H2O═HCl+HClO
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O═SO42﹣+2Fe2++4H+ , Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O,有关说法正确的是( )
A . 还原性Cr3+>Fe2+>SO2
B . 氧化性Cr2O72﹣>SO2>Fe3+
C . 两个反应中Fe2(SO4)3均作还原剂
D . Cr2O72﹣能将Na2SO3氧化成Na2SO4
下列反应属于氧化还原反应的是 ( )
A . CaCO3+2HCl=CaCl2+CO2↑+H2O
B . CO2+H2O=H2CO3
C . 2H2O2  2H2O+O2↑
D . CaCO3
2H2O+O2↑
D . CaCO3 CaO+CO2↑
CaO+CO2↑
 2H2O+O2↑
D . CaCO3
2H2O+O2↑
D . CaCO3
根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )

A . 反应①②③④⑤均属于氧化反应和离子反应
B . 反应⑤说明该条件下铝的还原性强于锰
C . 相同条件下生成等量的O2 , 反应③和④转移的电子数之比为1︰1
D . 反应①中氧化剂与还原剂的物质的量之比为1︰4
下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO ②HCl、H2O、H2SO4、HNO3 ③NaOH、Na2CO3、KOH、Cu(OH)2
-
(1) 三种物质依次是(填化学式):A;B;C ;
-
(2) 这三种物质相互作用可生成一种新物质NaHCO3 , 该反应(“是”或“不是”)氧化还原反应
-
(3) 写出物质C与足量稀硫酸反应的离子方程式
-
(4) HCO3-与H+、OH-在溶液中都不能大量共存,试用离子方程式说明:①②
下列化工生产没有涉及氧化还原反应的是( )
A . 工业合成氨
B . 工业制纯碱
C . 工业制烧碱
D . 工业制盐酸
N2H4·H2O(水合肼)极毒且不稳定,100℃以上易分解失水,常用作还原剂和除氧剂(通常生成N2和H2O),其熔点为-40℃,沸点118.5℃。现以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O和无水Na2SO3 , 其主要流程如下:
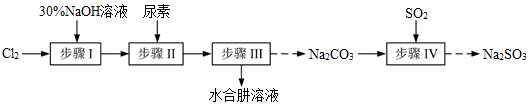
已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(aq) △H<0
-
(1) 配制30%NaOH溶液时,所需玻璃仪器除量筒、烧杯外,还需要_____________(填标号)。A . 容量瓶 B . 胶头滴管 C . 玻璃棒 D . 锥形瓶
-
(2) 步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液充分反应生成NaClO3和NaCl。实验中为控制反应温度除了用冰水浴、充分搅拌外,还需采取的措施是。
-
(3) 步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是(填字母);
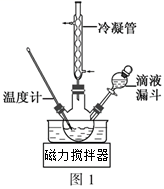
a.尿素溶液
b.NaClO碱性溶液
c.尿素溶液或NaClO溶液任选其一
理由是。
-
(4) 步骤Ⅲ中分离出N2H4·H2O应该采用的方法最合理是。
-
(5) 步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
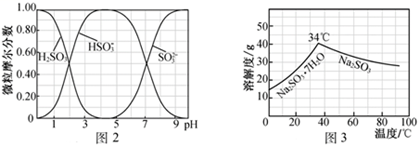
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的方法是。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:,用少量无水乙醇洗涤,干燥,密封包装。
-
(6) 工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:

还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是。
Fe与硝酸反应随温度和硝酸的浓度不同而产物不同。已知0.2molHNO3做氧化剂时,恰好把0.4molFe氧化为Fe2+ , 则HNO3将被还原成( )
A . NH4+
B . N2O
C . NO
D . NO2
中国传统文化源远流长,对人类文明贡献巨大,下列说法错误的是( )
A . “熬胆矾铁釜,久之亦化为铜”,该过程发生了氧化还原反应
B . “试玉要烧三日满,辨材须待七年期”中“玉”的成分是硅酸盐,该句诗表明玉的熔点很高
C . “蘸梦羊毫, 耕耘累累;开春猴棒,再拓涓涓”制作毛笔的羊毛是属于蛋白质
D . “青蒿一握,以水二升渍,绞取汁”,该方法提取青蒿素的过程属于化学变化
有关氧化还原反应的叙述正确的是( )
A . 氧化还原反应的实质是电子的转移(得失或偏移)
B . 氧化还原反应的实质是元素化合价的升降
C . 氧化还原反应的实质是有氧元素的得失
D . 物质所含元素化合价升高的反应是还原反应
固体化合物 X 由 3 种元素组成。某学习小组进行了如下实验:
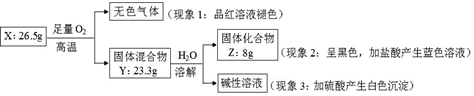
请回答:
-
(1) 由现象 1 得出化合物 X 含有元素(填元素符号),X 的化学式。
-
(2) 固体混合物 Y 的成分(填化学式)。
-
(3) 实验室常将氨气(NH3)通过红热的黑色固体化合物 Z 制备氮气,该反应的化学方程式是,当有28克氮气生成时转移的电子的物质的量为mol。
一定条件下,在水溶液中1molCl−、ClO x − (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
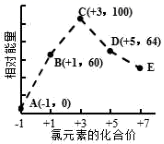
A . 这些离子中结合H+能力最强的是E
B . A,B,C,D,E五种微粒中C最稳定
C . C→B+D的反应,反应物的总键能小于生成物的总键能
D . B→A+D是吸热反应
用4mL1mol/LNa2SO3溶液还原含2×10-3molRO  的溶液,充分反应后剩余的Na2SO3溶液用0.2mol/LKMnO4酸性溶液氧化,消耗KMnO4酸性溶液2mL,则元素R在还原产物中的化合价是( )
的溶液,充分反应后剩余的Na2SO3溶液用0.2mol/LKMnO4酸性溶液氧化,消耗KMnO4酸性溶液2mL,则元素R在还原产物中的化合价是( )
 的溶液,充分反应后剩余的Na2SO3溶液用0.2mol/LKMnO4酸性溶液氧化,消耗KMnO4酸性溶液2mL,则元素R在还原产物中的化合价是( )
的溶液,充分反应后剩余的Na2SO3溶液用0.2mol/LKMnO4酸性溶液氧化,消耗KMnO4酸性溶液2mL,则元素R在还原产物中的化合价是( )
A . +1
B . +2
C . +3
D . +4
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
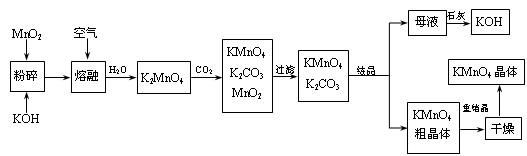
-
(1) KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。A . 75%酒精 B . 双氧水 C . 苯酚 D . 84消毒液(NaClO溶液)
-
(2) 写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
。
-
(3) 向K2MnO4溶液中通入CO2以制备KMnO4 , 该反应中的还原剂是:。
-
(4) 上述流程中可以循环使用的物质有石灰、二氧化碳、和(写化学式)。
-
(5) 若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得mol KMnO4。
从元素化合价的角度分析,下列物质中既有氧化性又有还原性的是( )
A . Ca2+
B . H+
C . Cl-
D . Fe2+
硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示。下列说法正确的是( )

A . 过程①中,生成CuS的反应为S2−+Cu2+=CuS↓
B . 过程②中,Fe3++CuS=Cu2++Fe2++S
C . 过程③中,溶液的酸性增强
D . 回收S的总反应为2H2S+O2 2H2O+2S↓
2H2O+2S↓
 2H2O+2S↓
2H2O+2S↓
锌是一种应用广泛的金属。一种以闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
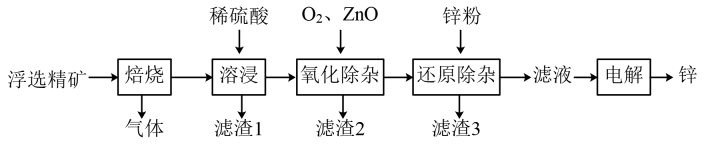
相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
-
(1) 焙烧过程中主要反应的化学方程式为。
-
(2) 滤渣1的主要成分除SiO2外还有。
-
(3) 氧化除杂工序中通入氧气的作用是,ZnO的作用是。
-
(4) 溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为。为什么不能省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+。
-
(5) 电解硫酸锌溶液制备单质锌时,阴极的电极反应式为;沉积锌后的电解液可返回工序继续使用。
-
(6) 改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,“氧压酸浸”中发生的主要反应的离子方程式为。
最近更新



