氧化还原反应 知识点题库
下列反应中水作为氧化剂的是( )
A . Cl2+H2O=HCl +HClO
B . 3Fe+4H2O(g) Fe3O4+4H2
C . 2F2+2H2O=4HF+O2
D . 3NO2+H2O=2HNO3+NO
Fe3O4+4H2
C . 2F2+2H2O=4HF+O2
D . 3NO2+H2O=2HNO3+NO
 Fe3O4+4H2
C . 2F2+2H2O=4HF+O2
D . 3NO2+H2O=2HNO3+NO
Fe3O4+4H2
C . 2F2+2H2O=4HF+O2
D . 3NO2+H2O=2HNO3+NO
下列反应中,既属于氧化还原反应,又属于离子反应的是( )
A . 铝片与稀盐酸的反应
B . 氢气与氧气的反应
C . 灼热的炭与二氧化碳反应生成一氧化碳
D . 氢氧化钠溶液与稀盐酸的反应
根据所学知识完成题目:
-
(1) 用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
-
(2) 钙元素是人体必需的常量元素,所有的细胞都需要钙元素.测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C204+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂 mol,有 mol电子发生转移,相当于测出含钙元素的质量是 g.
4.35g二氧化锰能与足量浓盐酸(密度为1.19g•cm﹣3、质量分数为36.5%)完全反应.求:
-
(1) 写出反应的化学方程式:;
-
(2) 浓盐酸中HCl的物质的量浓度:c(HCl)=;
-
(3) 被氧化的HCl的物质的量:n(HCl)=;
-
(4) 产生的氯气在标准状况下的体积:V(Cl2)=.
在Fe、Fe2+、Fe3+、S2﹣、SO2、Cu、H+、S等物质或粒子中:
-
(1) 只能被氧化,不能被还原的是;
-
(2) 只能被还原,不能被氧化的是.
Fe、Al分别与盐酸反应(结果可用分数表示):
-
(1) 若盐酸足量,等物质的量的Fe、Al产生H2的质量之比为.
-
(2) 若盐酸足量,等质量的Fe、Al产生H2的质量之比为.
-
(3) 若盐酸足量,等质量的Fe、Al产生H2在同温同压下的体积比为
下列物质的转化必须加入氧化剂且通过一步反应就能完成的是( )
①NO2→NO ②NO2→HNO3③N2→NO2④N2→NO ⑤N2→NH3 .
A . ①
B . ②⑤
C . ④
D . ③④
NaNO2可将正常的血红蛋白中的二价铁变为高铁血红蛋白中的三价铁,失去携氧能力。完成下列填空:
-
(1) N元素在元素周期表中位于第族,N原子最外层的电子排布式是。
-
(2) Na、N、O三种元素形成的简单离子中,离子半径最小的是(用离子符号表示)。
-
(3) 某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染。下列试剂中,能使NaNO2转化为N2的是(选填编号)。
a.NaCl
b.NH4Cl
c.HNO3
d.H2SO4
-
(4) 已知NaNO2能发生如下反应:NaNO2 + HI → NO↑+ I2 + NaI + H2O
①配平反应物的系数并标出电子转移的方向和数目
②当有0.75mol HI被氧化时,在标准状况下产生气体的体积是L。
-
(5) NaNO2外观与食盐相似,根据上述反应,可用于鉴别NaNO2和NaCl。现有 ①白酒、②碘化钾淀粉试纸、③淀粉、④白糖、⑤白醋,其中可选用的物质至少有(选填编号)。
下列反应中,既不属于四种基本反应类型,也不属于氧化还原反应的是( )
A . C(石墨)=C(金刚石)
B . CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
C . Cl2+2KBr=Br2+2KCl
D . 3CO+Fe2O3  2Fe+3CO2
2Fe+3CO2
 2Fe+3CO2
2Fe+3CO2
下列实验中,固体物质可以完全溶解的是()
A . 1molMnO2与含4molHCl的浓盐酸共热
B . 1molCu与含2molH2SO4的浓硫酸共热
C . 1molCu投入含4molHNO3的浓硝酸中
D . 常温下1molAl投入到足量浓硝酸中
氢化钠(NaH)是一种白色的离子化合物,其中钠元素是+1价;氢化钠与水反应生成H2和NaOH。下列叙述中,错误的是( )
A . NaH的电子式为Na+[:H]-
B . NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C . 微粒半径H-<Li+
D . NaH与H2O反应时,水作氧化剂
做实验时不小心粘了一些高锰酸钾,皮肤上的斑很久才能消除,如果用草酸的稀溶液洗
涤马上可以复原,其离子方程式为:MnO4- +C2O ![]() +H+
+H+  CO2
CO2  +Mn2++
+Mn2++ ![]() ,关于此
,关于此
反应的叙述正确的是( )
A . 该反应的氧化剂是C2O  B . 该反应右边方框内的产物是OH-
C . 配平该反应式后,H+的化学计量数是16
D . 该反应电子转移总数是5e-
B . 该反应右边方框内的产物是OH-
C . 配平该反应式后,H+的化学计量数是16
D . 该反应电子转移总数是5e-
某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热,N2使气囊迅速膨胀,从而起到保护作用。
-
(1) KClO4中氯元素的化合价是。
-
(2) Fe2O3可处理产生的Na,反应为
 ,反应中Na做(填“还原剂”或“氧化剂”)。
,反应中Na做(填“还原剂”或“氧化剂”)。
氮化铝(AlN)广泛应用于电子、陶瓷工业等领域。在一定条件下,AlN可通过如下反应制取:Al2O3+N2+3C  2AlN+3CO。下列叙述正确的是( )
2AlN+3CO。下列叙述正确的是( )
 2AlN+3CO。下列叙述正确的是( )
2AlN+3CO。下列叙述正确的是( )
A . AlN中氮的化合价为+3
B . AlN的摩尔质量为41g
C . 上述反应中,N2是氧化剂,Al2O3既不是氧化剂也不是还原剂。
D . 上述反应中,每生成1molAlN需转移6mol电子
已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2 , 下列氧化还原反应能发生的是( )
A . 2NaX+Z2=2NaZ+X2
B . 2NaW+Z2=2NaZ+W2
C . 2NaW+Y2=2NaY+W2
D . 2NaZ+X2=2NaX+Z2
某研究小组探究SO2和Fe(NO3)3溶液的反应。

已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,铁架台等夹持仪器已略去,请回答:
-
(1) 用于加入浓硫酸的仪器名称为。装置A中发生反应的化学方程式为。
-
(2) 滴加浓硫酸之前要先打开弹簧夹通入一定量的N2 , 其目的是。
-
(3) 实验中,装置B中产生了白色沉淀,该沉淀的成分是,说明SO2具有性
-
(4) 分析B中产生白色沉淀的原因:
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与
 反应;
反应;基于观点1,装置B中反应的离子方程式是,为证明该观点,应进一步检验生成的新物质,其实验操作及现象为(假定在反应中SO2的量不足)。
基于观点2,只需将装置B中Fe(NO3)3溶液替换为等体积的下列溶液,在相同的条件下进行实验。应选择的最佳试剂是(填序号)。
A.0.1mol·L-1的稀硝酸
B.1.5mol·L-1的Fe(NO3)3溶液
C.6.0mol·L-1 的NaNO3 和0.2mol·L-1盐酸等体积混合的混合液
氧化还原反应在工农业生产、日常生活中都有广泛的用途。
-
(1) “服用维生素C,可以使食物中的
 转化为
转化为  ”。维生素C在其中的作用是(填“氧化性”或“还原性”)。
”。维生素C在其中的作用是(填“氧化性”或“还原性”)。
-
(2) 野营爱好者携带氢化钙(
 )固体作生氢剂,则8.4g氢化钙与水反应时能产生标况下的
)固体作生氢剂,则8.4g氢化钙与水反应时能产生标况下的  L。
L。
-
(3)
 是一种广谱型的消毒剂。工业上常用
是一种广谱型的消毒剂。工业上常用  和
和  溶液混合并加
溶液混合并加  酸化即可反应制得。回答:
酸化即可反应制得。回答: ①
 中Cl元素的化合从是为。
中Cl元素的化合从是为。②工业制备
 中的氧化剂为。
中的氧化剂为。③写出制备
 的化学方程式并用双线桥表示该反应中电子转移的方向和数目。
的化学方程式并用双线桥表示该反应中电子转移的方向和数目。④自来水中加入13.5g
 气体进行消毒时,转移电子的总数为个。
气体进行消毒时,转移电子的总数为个。
我国古代“四大发明”对中华文明的发展产生了巨大的推动作用,也对世界文明发展史产生巨大的影响力。其中黑火药的爆炸反应:2KNO3+S+3C  K2S+N2↑+3CO2↑。该反应中被还原的元素是( )
K2S+N2↑+3CO2↑。该反应中被还原的元素是( )
 K2S+N2↑+3CO2↑。该反应中被还原的元素是( )
K2S+N2↑+3CO2↑。该反应中被还原的元素是( )
A . 只有C
B . 只有N
C . N和C
D . N和S
氢化钠(NaH)可在野外用作生氢剂,其中氢元素化合价为-1价,化学反应原理为: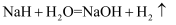 。下列有关该反应的说法正确的是( )
。下列有关该反应的说法正确的是( )
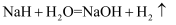 。下列有关该反应的说法正确的是( )
。下列有关该反应的说法正确的是( )
A . NaH是氧化剂
B .  中氢元素被氧化
C . 该反应属于置换反应
D .
中氢元素被氧化
C . 该反应属于置换反应
D .  既是氧化产物又是还原产物
既是氧化产物又是还原产物
 中氢元素被氧化
C . 该反应属于置换反应
D .
中氢元素被氧化
C . 该反应属于置换反应
D .  既是氧化产物又是还原产物
既是氧化产物又是还原产物
我国古代四大发明之一的黑火药由硫黄粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。下列关于该反应的说法正确的是( )
A . 碳失电子,发生还原反应
B . 硝酸钾中N元素化合价降低,被氧化
C . 氧化剂与还原剂质量之比是1:1
D . 32g S参与反应时,得到3mol的氧化产物
最近更新



