ж°§еҢ–иҝҳеҺҹеҸҚеә” зҹҘиҜҶзӮ№йўҳеә“
 2Fe+3CO2 пјҢ дёӢеҲ—жңүе…іиҜҘеҸҚеә”зҡ„иҜҙжі•жӯЈзЎ®пјҲВ В пјү
2Fe+3CO2 пјҢ дёӢеҲ—жңүе…іиҜҘеҸҚеә”зҡ„иҜҙжі•жӯЈзЎ®пјҲВ В пјү
 Si+2COвҶ‘пјҺиҜҘеҸҚеә”дёӯпјҢиҝҳеҺҹеүӮжҳҜпјҲеЎ«еҢ–еӯҰејҸпјүпјҢиў«иҝҳеҺҹзҡ„зү©иҙЁжҳҜпјҲеЎ«еҢ–еӯҰејҸпјүпјӣиӢҘеҸҚеә”дёӯж¶ҲиҖ—дәҶ1.5mol CпјҢеҲҷз”ҹжҲҗmol SiпјҢиҪ¬з§»з”өеӯҗзҡ„зү©иҙЁзҡ„йҮҸдёәmolпјҺ
Si+2COвҶ‘пјҺиҜҘеҸҚеә”дёӯпјҢиҝҳеҺҹеүӮжҳҜпјҲеЎ«еҢ–еӯҰејҸпјүпјҢиў«иҝҳеҺҹзҡ„зү©иҙЁжҳҜпјҲеЎ«еҢ–еӯҰејҸпјүпјӣиӢҘеҸҚеә”дёӯж¶ҲиҖ—дәҶ1.5mol CпјҢеҲҷз”ҹжҲҗmol SiпјҢиҪ¬з§»з”өеӯҗзҡ„зү©иҙЁзҡ„йҮҸдёәmolпјҺ
-
пјҲ1пјү иҜҘеҸҚеә”зҡ„ж°§еҢ–еүӮжҳҜпјҢж°§еҢ–дә§зү©жҳҜ
-
пјҲ2пјү иҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә
-
пјҲ3пјү иҜ·з”ЁвҖңеҸҢзәҝжЎҘжі•вҖқж ҮеҮәиҜҘеҸҚеә”з”өеӯҗиҪ¬з§»зҡ„ж–№еҗ‘е’Ңж•°зӣ®пјҺ
-
пјҲ4пјү иҜҘеҸҚеә”ж°§еҢ–еүӮдёҺиҝҳеҺҹеүӮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәпјҺ
| йҖүйЎ№ | е®һйӘҢ | зҺ°иұЎ |
| A | еҗ‘йҘұе’ҢNa2CO3жә¶ж¶ІдёӯйҖҡе…Ҙи¶ійҮҸзҡ„CO2ж°”дҪ“ | ж— жҳҺжҳҫзҺ°иұЎ |
| B | еңЁй…’зІҫзҒҜдёҠеҠ зғӯй“қз®” | й“қз®”зҶ”еҢ–пјҢеӨұеҺ»е…үжіҪпјҢзҶ”еҢ–зҡ„й“қж»ҙиҗҪдёӢжқҘ |
| C | еҗ‘д№…зҪ®дәҺз©әж°”дёӯзҡ„FeSO4жә¶ж¶Ідёӯж»ҙеҠ NaOHжә¶ж¶І | з«ӢеҲ»дә§з”ҹеӨ§йҮҸзҷҪиүІжІүж·Җ |
| D | еҠ зғӯж”ҫеңЁеқ©еҹҡдёӯзҡ„е°Ҹеқ—й’ | й’ е…ҲзҶ”еҢ–жҲҗе…үдә®зҡ„е°ҸзҗғпјҢзҮғзғ§ж—¶зҒ«з„°дёәй»„иүІпјҢзҮғзғ§еҗҺз”ҹжҲҗж·Ўй»„иүІеӣәдҪ“ |
-
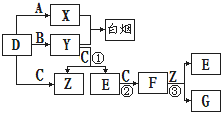
пјҲ1пјү Dзҡ„еҢ–еӯҰејҸдёә гҖӮ
-
пјҲ2пјү еҸҚеә”в‘ўзҡ„зҰ»еӯҗж–№зЁӢејҸдёә гҖӮ
-
пјҲ3пјү Yе’ҢEеңЁдёҖе®ҡжқЎд»¶дёӢеҸҜеҸҚеә”з”ҹжҲҗBе’ҢZпјҢиҝҷжҳҜдёҖдёӘе…·жңүе®һйҷ…ж„Ҹд№үзҡ„еҸҚеә”пјҢеҸҜж¶ҲйҷӨEеҜ№зҺҜеўғзҡ„жұЎжҹ“пјҢиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә гҖӮ
 CuCl2
B . CO2
CuCl2
B . CO2  CO
C . I-
CO
C . I-  I2
D . H2O
I2
D . H2O  H2
H2
 2Cu+CO2вҶ‘
D . 4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Cu+CO2вҶ‘
D . 4Fe(OH)2+O2+2H2O=4Fe(OH)3
-
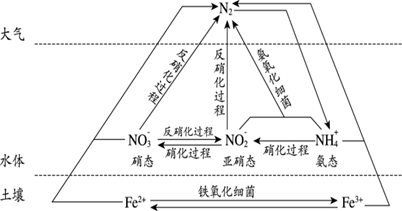
пјҲ1пјү еӣҫдёӯжүҖзӨәж°®еҫӘзҺҜдёӯпјҢдёҚеұһдәҺж°®зҡ„еӣәе®ҡзҡ„жңү(еЎ«еӯ—жҜҚеәҸеҸ·)гҖӮ
a. N2 иҪ¬еҢ–дёәж°ЁжҖҒж°® b. зЎқеҢ–иҝҮзЁӢc.еҸҚзЎқеҢ–иҝҮзЁӢ d.N2иҪ¬еҢ–дёәзЎқжҖҒж°®
-
пјҲ2пјү ж°®иӮҘжҳҜж°ҙдҪ“дёӯж°ЁжҖҒж°®зҡ„дё»иҰҒжқҘжәҗд№ӢдёҖгҖӮ
в‘ ж°Ёж°”жҳҜз”ҹдә§ж°®иӮҘзҡ„дё»иҰҒеҺҹж–ҷпјҢе®һйӘҢе®ӨеҲ¶еҸ–ж°Ёж°”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
в‘ЎжЈҖйӘҢж°ЁжҖҒж°®иӮҘдёӯNH
 зҡ„е®һйӘҢж–№жЎҲжҳҜгҖӮ
зҡ„е®һйӘҢж–№жЎҲжҳҜгҖӮ -
пјҲ3пјү еҸҚзЎқеҢ–иҝҮзЁӢдёӯпјҢеҗ«ж°®зү©иҙЁеҸ‘з”ҹ(еЎ«вҖңж°§еҢ–вҖқжҲ–вҖңиҝҳеҺҹвҖқ)еҸҚеә”гҖӮ
-
пјҲ4пјү ж°ЁжҖҒж°®дёҺдәҡзЎқжҖҒж°®еҸҜд»ҘеңЁж°Ёж°§еҢ–з»ҶиҸҢзҡ„дҪңз”ЁдёӢиҪ¬еҢ–дёәж°®ж°”гҖӮиҜҘеҸҚеә”дёӯпјҢеҪ“дә§з”ҹ 0.03 mol ж°®ж°”ж—¶пјҢиҪ¬з§»зҡ„з”өеӯҗзҡ„зү©иҙЁзҡ„йҮҸдёәmolгҖӮ
-
пјҲ5пјү еңҹеЈӨдёӯзҡ„й“ҒеҫӘзҺҜеҸҜз”ЁдәҺж°ҙдҪ“и„ұж°®(и„ұж°®жҳҜжҢҮе°Ҷж°®е…ғзҙ иҪ¬еҢ–дёәж°”дҪ“д»Һж°ҙдҪ“дёӯйҷӨеҺ»)пјҢз”ЁзҰ»еӯҗж–№зЁӢејҸеҲҶеҲ«иҜҙжҳҺеҲ©з”ЁеңҹеЈӨдёӯ(й…ёжҖ§)зҡ„й“ҒеҫӘзҺҜи„ұйҷӨж°ҙдҪ“дёӯзЎқжҖҒж°®е’Ңж°ЁжҖҒж°®зҡ„еҺҹзҗҶпјҡгҖҒгҖӮ
-
пјҲ6пјү NOxжҳҜжұҪиҪҰе°ҫж°”дёӯзҡ„дё»иҰҒжұЎжҹ“зү©д№ӢдёҖпјҢNOxиғҪеҪўжҲҗй…ёйӣЁпјҢз”ЁжҹҙжІ№зҡ„жұҪиҪҰеҠ иЈ…е°ҝзҙ з®ұеҸҜдҪҝе°ҫж°”иҫҫж ҮпјҢе…¶еҺҹзҗҶдёә CO(NH2)2+X=CO2+2NH3еҲҷXзҡ„еҢ–еӯҰејҸдёәгҖӮж°Ёж°”е’ҢNOxеҸҜд»ҘиҪ¬еҢ–дёәж— е®іж°”дҪ“пјҢеҶҷеҮәNO2е’Ң NH3еӮ¬еҢ–еҠ зғӯжқЎд»¶дёӢзҡ„еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸ
-
пјҲ1пјү иҜҘеҸҚеә”дёӯеҸ‘з”ҹиҝҳеҺҹеҸҚеә”зҡ„зү©иҙЁжҳҜпјҢж°§еҢ–дә§зү©жҳҜгҖӮ
-
пјҲ2пјү з”ЁеҸҢзәҝжЎҘж ҮеҮәж–№зЁӢејҸдёӯзҡ„з”өеӯҗеҫ—еӨұпјҡгҖӮ2KClO3+4HCl(жө“)==2KCl+Cl2вҶ‘+2ClO2+2H2O
-
пјҲ3пјү еҪ“жңү0.2molз”өеӯҗеҸ‘з”ҹиҪ¬з§»ж—¶пјҢз”ҹжҲҗзҡ„ж°Ҝж°”зҡ„дҪ“з§Ҝдёә L(ж ҮеҮҶзҠ¶еҶө)пјҢиў«ж°§еҢ–зҡ„HClжңүmolгҖӮ
 CaCl2+2NH3вҶ‘+2H2Oпјү
CaCl2+2NH3вҶ‘+2H2Oпјү 
-
пјҲ1пјү AеҸ‘з”ҹиЈ…зҪ®Nе…ғзҙ зҡ„еҢ–еҗҲд»·жҳҜпјҢиҜҘеҸҚеә”жҳҜеҗҰжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә”еЎ«пјҲвҖңжҳҜвҖқжҲ–вҖңеҗҰвҖқпјүгҖӮз”ІгҖҒд№ҷгҖҒдёҷдёүдҪҚеҗҢеӯҰеҲҶеҲ«з”ЁеҰӮеӣҫжүҖзӨәдёүеҘ—е®һйӘҢиЈ…зҪ®еҸҠеҢ–еӯҰиҚҜе“ҒжқҘеҲ¶еҸ–ж°Ёж°”

е…¶дёӯжңүдёҖдҪҚеҗҢеӯҰжІЎжңүе®ҢжҲҗеҲ¶еҸ–并жҺўз©¶ж°Ёж°”жҖ§иҙЁе®һйӘҢпјҲеҰӮжһң他们зҡ„е®һйӘҢж“ҚдҪңйғҪжӯЈзЎ®пјүпјҢдҪ и®ӨдёәжІЎжңү收йӣҶеҲ°ж°Ёж°”зҡ„еҗҢеӯҰжҳҜеЎ«пјҲвҖңз”ІвҖқгҖҒвҖңд№ҷвҖқжҲ–вҖңдёҷвҖқпјүпјҢ收йӣҶдёҚеҲ°ж°Ёж°”зҡ„дё»иҰҒеҺҹеӣ жҳҜпјҲз”ЁеҢ–еӯҰж–№зЁӢејҸиЎЁзӨәпјүгҖӮиӢҘз”ЁеҰӮеӣҫиЈ…зҪ®д»ЈжӣҝдёҠиҝ°AиЈ…зҪ®жқҘе®ҢжҲҗе®һйӘҢпјҢиЈ…зҪ®дёӯеҠ е…ҘиҜ•еүӮеҗҲзҗҶзҡ„жҳҜгҖӮ

aпјҺжө“ж°Ёж°ҙ
bпјҺжө“ж°Ёж°ҙдёҺCaO
cпјҺNH4ClдёҺCaпјҲOHпјү2
-
пјҲ2пјү з”Ё5.35 g NH4ClеӣәдҪ“дёҺи¶ійҮҸCaпјҲOHпјү2еҸҚеә”пјҢжңҖеӨҡеҸҜеҲ¶еҫ—ж ҮеҮҶзҠ¶еҶөдёӢж°Ёж°”зҡ„дҪ“з§ҜдёәLгҖӮпјҲNH4Clзҡ„ж‘©е°”иҙЁйҮҸдёә53.5 g/molпјү
-
пјҲ3пјү ж°”дҪ“йҖҡиҝҮCгҖҒDиЈ…зҪ®ж—¶пјҢиҜ•зәёйўңиүІдјҡеҸ‘з”ҹеҸҳеҢ–зҡ„жҳҜDпјҢеҺҹеӣ жҳҜгҖӮ
-
пјҲ4пјү еҪ“е®һйӘҢиҝӣиЎҢдёҖж®өж—¶й—ҙеҗҺпјҢжҢӨеҺӢEиЈ…зҪ®дёӯзҡ„иғ¶еӨҙж»ҙз®ЎпјҢж»ҙе…Ҙ1~2ж»ҙжө“зӣҗй…ёпјҢеҸҜи§ӮеҜҹеҲ°зҡ„зҺ°иұЎжҳҜгҖӮ
-
пјҲ5пјү иӢҘ收йӣҶдёҖйӣҶ气瓶氨气пјҢжЈҖйӘҢж°Ёж°”жҳҜеҗҰ收йӣҶж»Ўзҡ„ж–№жі•жҳҜгҖӮ
-
пјҲ6пјү жҹҗеҗҢеӯҰз”ЁеҰӮеӣҫжүҖзӨәиЈ…зҪ®иҝӣиЎҢж°Ёж°”зҡ„жҖ§иҙЁе®һйӘҢпјҢж №жҚ®зғ§з“¶еҶ…дә§з”ҹзәўиүІе–·жіүзҡ„зҺ°иұЎпјҢиҜҙжҳҺж°Ёж°”е…·жңүжҖ§иҙЁеЎ«еәҸеҸ·гҖӮ

aпјҺиҝҳеҺҹжҖ§
bпјҺжһҒжҳ“жә¶дәҺж°ҙ
cпјҺдёҺж°ҙеҸҚеә”з”ҹжҲҗзўұжҖ§зү©иҙЁ
-
пјҲ7пјү ж°Ёж°”зҡ„з”ЁйҖ”еҫҲе№ҝгҖӮеҰӮеҸҜз”Ёж°Ёж°”еӨ„зҗҶдәҢж°§еҢ–ж°®пјҡ8NH3+6NO2=7N2+12H2OпјҢиҜҘеҸҚеә”дёӯж°Ёж°”дҪ“зҺ°пјҲеЎ«вҖңж°§еҢ–жҖ§вҖқжҲ–вҖңиҝҳеҺҹжҖ§вҖқпјүгҖӮ
| йҖүйЎ№ | е®һйӘҢж“ҚдҪңе’ҢзҺ°иұЎ | з»“и®ә |
| A | е°ҶзҮғзқҖзҡ„й•ҒжқЎиҝ…йҖҹдјёе…ҘйӣҶж»ЎCO2зҡ„йӣҶ气瓶пјҢеү§зғҲеҸҚеә”пјҢеҸ‘е…үеҸ‘зғӯпјҢ瓶еҶ…дә§з”ҹеӨ§йҮҸзҷҪзғҹпјҢ瓶еЈҒдёҠжңүй»‘иүІйў—зІ’ | CO2еңЁдёҖе®ҡжқЎд»¶дёӢиғҪж”ҜжҢҒзҮғзғ§ |
| B | еҗ‘NaClгҖҒNaIзҡ„ж··еҗҲзЁҖжә¶ж¶Ідёӯж»ҙе…Ҙе°‘йҮҸзЁҖAgNO3жә¶ж¶ІпјҢжңүй»„иүІжІүж·Җз”ҹжҲҗ | |
| C | е®Өжё©дёӢпјҢеҗ‘FeCl3жә¶ж¶Ідёӯж»ҙеҠ е°‘йҮҸKIжә¶ж¶ІпјҢеҶҚж»ҙеҠ еҮ ж»ҙж·ҖзІүжә¶ж¶ІпјҢжә¶ж¶ІеҸҳи“қиүІ | Fe3+зҡ„ж°§еҢ–жҖ§жҜ”I2зҡ„ејә |
| D | е°Ҷе°‘йҮҸй“ҒзІүгҖҒ5mLиӢҜе’Ң1mLж¶Іжәҙж··еҗҲеҗҺдә§з”ҹзҡ„ж°”дҪ“йҖҡе…ҘAgNO3жә¶ж¶ІдёӯпјҢдә§з”ҹж·Ўй»„иүІжІүж·Җ | иӢҜе’Ңж¶ІжәҙеҸ‘з”ҹдәҶеҸ–д»ЈеҸҚеә” |

дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү





